Anhídridos de Ácido: Cómo se Forman, Aplicaciones y Ejemplos
Los anhídridos de ácido se consideran de gran importancia entre la amplia variedad de compuestos de origen orgánico que existen. Estos se presentan como moléculas que poseen dos grupos acilo (sustituyentes orgánicos cuya fórmula es RCO-, donde R es una cadena carbonada) unidos al mismo átomo de oxígeno.
Asimismo, hay una clase de anhídridos ácidos que se encuentra comúnmente: los anhídridos carboxílicos, llamados así porque el ácido de partida es un ácido carboxílico. Para nombrar a los de este tipo cuya estructura sea simétrica, solo debe hacerse una sustitución de términos.
Debe sustituirse la expresión ácido en la nomenclatura de su ácido carboxílico original por el término anhídrido, que significa “sin agua”, sin alterar el resto del nombre de la molécula formada. Estos compuestos también pueden generarse partiendo de uno o dos grupos acilo provenientes de otros ácidos orgánicos, como el ácido fosfónico o el ácido sulfónico.
De manera similar se pueden originar anhídridos ácidos teniendo como base un ácido inorgánico, tal como el ácido fosfórico. Sin embargo, sus propiedades físicas y químicas, sus aplicaciones y demás características dependen de la síntesis llevada a cabo y la estructura del anhídrido.
Índice del artículo
- 1 ¿Cómo se forman los anhídridos de ácido?
- 2 Fórmula general
- 3 Aplicaciones
- 4 Ejemplos de anhídridos de ácido
- 5 Referencias
Algunos anhídridos de ácido se originan por distintas vías, ya sea en el laboratorio o en la industria. En la síntesis industrial se tiene como ejemplo el anhídrido acético, el cual es producido principalmente mediante el proceso de carbonilación de la molécula de acetato de metilo.
Otro ejemplo de estas síntesis es el del anhídrido maleico, que se genera a través de la oxidación de la molécula de benceno o la de butano.
Sin embargo, en la síntesis de los anihídridos ácidos en el laboratorio se hace énfasis en la deshidratación de los ácidos correspondientes, como la producción del anhídrido etanoico, en el cual se deshidratan dos moléculas de ácido etanoico para dar origen al compuesto mencionado.
Puede ocurrir también una deshidratación intramolecular; es decir, dentro de la misma molécula de un ácido con dos grupos carboxilo (o dicarboxílico), pero si ocurre lo contrario y un anhídrido ácido sufre una hidrólisis, ocurre la regeneración de los ácidos que lo originaron.
Se denominan simétricos los anhídridos de ácido cuyos sustituyentes acilo son iguales, mientras que en los anhídridos de este tipo considerados mixtos estas moléculas acilo son distintas.
Sin embargo, también se generan estas especies cuando ocurre una reacción entre un haluro de acilo (cuya fórmula general es un (RCOX)) con una molécula de carboxilato (cuya fórmula general es R’COO-)). [2]
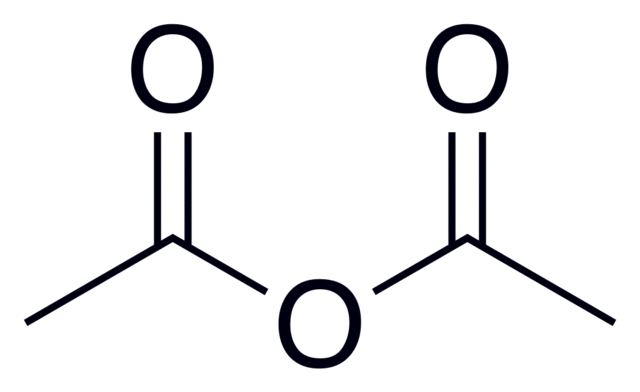
La fórmula general de los anhídridos de ácido es (RC(O))2O, la cual se observa de mejor manera en la imagen colocada al comienzo de este artículo.
Por ejemplo, para el anhídrido acético (proveniente del ácido acético) la fórmula general es (CH3CO)2O, escribiéndose de manera similar para muchos otros anhídridos ácidos parecidos.
Como se dijo anteriormente, estos compuestos poseen casi el mismo nombre de sus ácidos precursores, y lo único que cambia es el término ácido por anhídrido, pues deben seguirse las mismas reglas de numeración de los átomos y sustituyentes para acertar con su nomenclatura.
Los anhídridos ácidos tienen muchas funciones o aplicaciones dependiendo del campo que se esté estudiando pues, al poseer alta reactividad, pueden ser reactivos precursores o formar parte de muchas reacciones importantes.
Un ejemplo de esto es la industria, donde el anhídrido acético es producido en grandes cantidades por ser el de estructura más simple que puede ser aislado. Este anhídrido es utilizado como reactivo en síntesis orgánicas importantes, como la de ésteres de acetato.
Por otro lado, el anhídrido maleico se muestra con una estructura cíclica, siendo utilizado en la producción de coberturas para uso industrial y como precursor de algunas resinas a través del proceso de copolimerización con moléculas de estireno. Además, esta sustancia funge como dienófilo cuando se lleva a cabo la reacción de Diels-Alder.
De modo similar, existen compuestos que poseen dos moléculas de anhídridos ácidos en su estructura, como el dianhídrido etilentetracarboxílico o el dianhídrido benzoquinontetracarboxílico, que son empleados en la síntesis de ciertos compuestos como las poliimidas o algunas poliamidas y poliésteres.
Además de estos, se tiene un anhídrido mixto llamado 3′-fosfoadenosín-5′-fosfosulfato, proveniente de los ácidos fosfórico y sulfúrico, el cual constituye la coenzima más común en reacciones biológicas de transferencia de sulfato.
A continuación se presenta una lista con los nombres de algunos anhídridos de ácido, para dar algunos ejemplos de estos compuestos tan importantes en la química orgánica que pueden formar compuestos de estructura lineal o anillos de varios miembros:
– Anhídrido acético.
– Anhídrido propanoico.
– Anhídrido benzoico.
– Anhídrido maleico.
– Anhídrido succínico.
– Anhídrido ftálico.
– Dianhídrido naftalentetracarboxílico.
– Dianhídrido etilentetracarboxílico.
– Dianhídrido benzoquinontetracarboxílico.
Así como se forman estos anhídridos con oxígeno, se dan otros compuestos donde un átomo de azufre puede sustituir al oxígeno tanto en el grupo carbonilo como el oxígeno central, como por ejemplo:
– Anhídrido tioacético (CH3C(S)2O)
Incluso se da el caso de dos moléculas acilo que forman enlaces con el mismo átomo de azufre; estos compuestos son llamados tioanhídridos, a saber:
– Tioanhídrido acético ((CH3C(O))2S)
- Wikipedia. (2017). Wikipedia. Recuperado de en.wikipedia.org
- Johnson, A. W. (1999). Invitation to Organic Chemistry. Recuperado de books.google.co.ve.
- Acton, Q. A. (2011). Acid Anhydride Hydrolases: Advances in Research and Application. Recuperado de books.google.co.ve
- Bruckner, R., y Harmata, M. (2010). Organic Mechanisms: Reactions, Stereochemistry and Synthesis. Recuperado de books.google.co.ve
- Kim, J. H., Gibb, H. J., e Iannucci, A. (2009). Cyclic Acid Anhydrides: Human Health Aspects. Recuperado de books.google.co.ve
