Sulfato de cobre pentahidratado: estructura, propiedades, usos
El sulfato de cobre pentahidratado es un compuesto inorgánico formado por los elementos cobre (Cu), azufre (S), oxígeno (O) y por agua (H2O). Contiene los iones cobre (II) (Cu2+) y sulfato (SO42-). Su fórmula química es CuSO4•5H2O.
En la naturaleza se encuentra formando el mineral chalcantita o calcantita, también llamado chalclasa o calclasa. Es un sólido cristalino azul.

Se utiliza como complemento alimenticio para algunos animales como rumiantes, cerdos y aves de corral. En agricultura sirve como pesticida. En actividades mineras permite recuperar otros metales.
Por su tonalidad azul sirve para la coloración de telas y metales. Se ha utilizado para depositar cobre metálico sobre fibras de celulosa para obtener telas conductoras de electricidad. También se usa para preparar nanopartículas de cobre y sus óxidos, con variedad de aplicaciones.
En altas concentraciones puede ser tóxico para la fauna y la flora, por ello en ocasiones se emplea para eliminar plagas (animales o plantas) de ambientes acuáticos como lagunas y estanques naturales.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos
- 6 Efectos sobre el medio ambiente
- 7 Referencias
Este compuesto está formado por el elemento cobre en su estado de oxidación +2 y el anión sulfato. Este último tiene un átomo de azufre con valencia +6 rodeado por cuatro átomos de oxígeno, cada uno con valencia -2. De esta forma el ion sulfato posee dos cargas negativas.
Además tiene 5 moléculas de agua en su estructura. En la siguiente figura se puede apreciar la forma en que están dispuestos los diversos átomos en el cristal.
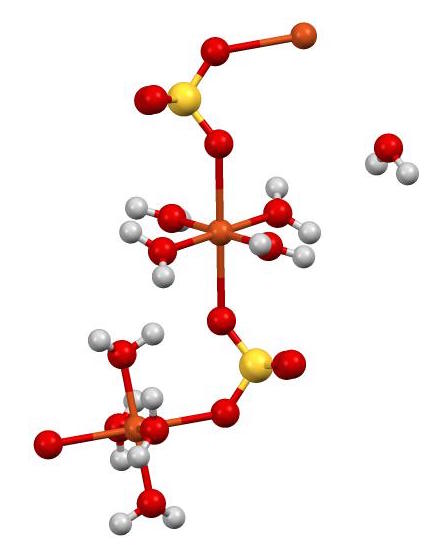
El Cu2+ (esferas color naranja) está coordinado simultáneamente con 4 moléculas de H2O (oxígeno = rojo; hidrógeno = blanco) y con 2 átomos de oxígeno de los SO42- (azufre = amarillo). En la figura una de las moléculas de H2O está en aparente libertad pero forma parte de la estructura cristalina.

- Sulfato de cobre pentahidratado
- Sufato de cobre (II) pentahidratado
- Vitriolo azul
- Piedra azul (del inglés blue stone)
- Chalcantita, calcantita, chalclasa o calclasa
Sólido cristalino azul.
249,686 g/mol
Al llegar a 110 ºC se descompone.
2,286 g/cm3
Soluble en agua: 22,0 g/100 g de agua a 25 °C. Soluble en metanol (CH3OH). Ligeramente soluble en etanol (CH3CH2OH).
Este compuesto al entrar en contacto con agua se disuelve formando los iones Cu2+ y SO42-. Su solubilidad en agua disminuye significativamente si en el agua está presente ácido sulfúrico.
El H2SO4 proporciona iones SO42- y su presencia genera el efecto de “ion común”, pues este ion está presente en el sulfato de cobre pentahidratado. La disolución se puede expresar así:
CuSO4•5H2O (sólido) + agua ⇔ Cu2+ + SO42- + agua
Por lo tanto, si ya en solución está presente el SO42- del ácido sulfúrico, el equilibrio se desplaza hacia la izquierda, es decir, hacia la formación del sólido y así la solubilidad disminuye.
Una de las formas de obtener el sulfato de cobre pentahidratado es disolviendo el mineral malaquita en solución acuosa de ácido sulfúrico (H2SO4) a temperatura controlada. La malaquita contiene Cu2(OH)2CO3 con otras impurezas, como por ejemplo hierro.
La solución impura de cobre (II) se trata con peróxido de hidrógeno (H2O2) para asegurar que las impurezas de hierro (II) (Fe2+) se conviertan en hierro (III) (Fe3+). Este último se hace precipitar en forma de hidróxido férrico (Fe(OH)3) utilizando hidróxido de sodio (NaOH).
Precipitar significa que se forman partículas de un sólido insoluble en la solución, el cual cae al fondo del recipiente que la contiene.

La mezcla resultante se filtra para eliminar el sólido de Fe(OH)3 y el líquido remanente se trata con etanol (C2H5OH), metanol (CH3OH) o ácido sulfúrico para precipitar todos los iones Cu2+ en forma de CuSO4•5H2O.
Cuando se agrega por ejemplo etanol hay menos agua disponible para que los iones Cu2+ y SO42- estén en solución y tienden a unirse entre sí. Actúa como un deshidratante. Mientras más etanol se agrega más sólido se forma.
El sólido precipitado se puede recristalizar para purificarlo. Para ello se disuelve en agua a una temperatura de 80-90 °C y luego la solución se enfría a 25-30 °C. El compuesto pentahidratado vuelve a precipitar y las impurezas permanecen en solución.
Tiene un amplio intervalo de aplicaciones comerciales.
En el área de la agricultura sirve como pesticida, insecticida, herbicida, fungicida, germicida y aditivo para suelos. En terapias veterinarias se emplea como antihelmíntico, fungicida y emético (para causar vómito).
Se utiliza como pigmento azul o verde en tintes y colorantes, como mordiente en la coloración de telas y metales. También como tóner de impresión en fotografías y como reactivo para intensificar los negativos.
Se emplea en las actividades de minería como reactivo de flotación para la recuperación de cinc y plomo. Sirve para producir otros compuestos de cobre, se utiliza en el curtido de cueros y para conservar la madera.
Este compuesto es usado en la dieta de los cerdos en muy pequeñas cantidades como promotor del crecimiento, especialmente en la fase posterior al destete. Aún se desconoce el mecanismo por el cual tiene dicho efecto.
Algunos investigadores afirman que reduce la población de bacterias patógenas o dañinas en el intestino de los animales y en consecuencia favorece su crecimiento.

Otros estudiosos indican que mejora la salud del intestino de dichos animales, pero ciertas investigaciones indican que la inyección intravenosa de cobre también mejora su crecimiento.
También se ha empleado con la misma finalidad en aves de corral, y se ha utilizado en la deficiencia de cobre de los rumiantes.
El sulfato de cobre pentahidratado se ha utilizado para obtener nanopartículas mixtas de cobre y óxido de cobre (I) (Cu/Cu2O).
Las nanopartículas son estructuras extremadamente pequeñas que se pueden ver solo a través de un microscopio electrónico.
El polvo de Cu/Cu2O en forma de nanopartículas tiene uso en catálisis o aceleración de reacciones químicas, en semiconductores y en materiales antimicrobianos, entre otras aplicaciones.
El CuSO4•5H2O ha sido utilizado en experiencias para evaluar su toxicidad hacia los caracoles de la especie Pomacea canaliculata.
Estos son moluscos nativos de las regiones tropicales de América del Sur que habitan diversos tipos de ecosistemas, desde pantanos y lagunas hasta lagos y ríos.
Son estudiados porque algunos hospedan parásitos humanos como el Schistosoma mansoni (trematodo que produce la enfermedad de la bilharzia). Los caracoles también pueden ser perjudiciales para los cultivos agrícolas de regiones inundadas.


De acuerdo con los estudios revisados las soluciones acuosas de sulfato de cobre pentahidratado son extremadamente tóxicas para dichos caracoles, por lo que este compuesto puede ser utilizado para eliminar el molusco de las zonas infestadas.
Según ciertas investigaciones esto se debe a que el caracol no tiene ninguna necesidad del ion cobre, por lo que apenas el contacto con este ion sería suficiente para que ocurra la muerte del animal.
Se ha empleado este compuesto en la obtención de materiales textiles con sensores integrados de electricidad. Este tipo de telas tiene aplicación en dispositivos de almacenamiento de electricidad, sensores de presión, fotodetectores y pantallas emisoras de luz.
Para obtener telas conductoras de electricidad se recubre con cobre metálico una fibra semisintética de celulosa tejida denominada “Lyocell”. El recubrimiento se realiza de forma no electrolítica partiendo de una solución de CuSO4•5H2O y otros compuestos químicos auxiliares.

La tela obtenida de esta forma puede transferir una señal eléctrica aún bajo condiciones de deformación o estiramiento manteniendo una alta conductividad.
Como se explicó anteriormente el CuSO4•5H2O al disolverse en agua genera el ion cobre (II).
Aunque el cobre es esencial en concentraciones bajas para las actividades celulares de los organismos vivos, en altas concentraciones puede ser tóxico e incluso causar la muerte.
Por tanto, la presencia de dicho ion en el ambiente constituye un riesgo para animales y plantas. En ecosistemas acuáticos puede llegar a bioacumularse en los seres vivos y en la cadena alimenticia, causando daño.

De hecho, en ciertas experiencias se ha encontrado que la contaminación de ambientes acuáticos con sulfato de cobre pentahidratado causa que la biomasa de ciertas plantas acuáticas disminuye.
Lo que significa que las plantas crecen menos en presencia de esta sal en altas concentraciones.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Kokes, H. et al. (2014). Dissolution of copper and iron from malachite ore and precipitation of copper sulfate pentahydrate by chemical process. Engineering Science and Technology, an International Journal. 2014; 17(1): 39-44. Recuperado de sciencedirect.com.
- Alves de Azevedo B., J.P. and Peixoto, M.N. (2015). Biomass reduction of Salvinia molesta exposed to copper sulfate pentahydrate (CuSO4.5H2O). Rev. Ambient. Agua 2015; 10(3): 520-529. Recuperado de doaj.org.
- Root, W. et al. (2019). Flexible Textile Strain Sensor Based on Copper-Coated Lyocell Type Cellulose Fabric. Polymers 2019, 11, 784. Recuperado de mdpi.com.
- Pitelli, R.A. et al. (2008). Acute toxicity of copper sulfate and aqueous extract of dried neem leaves on snails (Pomacea canaliculata). Acta Sci. Biol. Sci. 2008; 30(2):179-184. Recuperado de doaj.org.
- Badawy, S.M. et al. (2015). Synthesis, Characterization and Catalytic Activity of Cu/Cu2O Nanoparticles Prepared in Aqueous Medium. Bulletin of Chemical Reaction Engineering & Catalysis. 2015; 10(2): 169-174. Recuperado de doaj.org.
- Justel, F.J. et al (2014). Solubilities and physical properties of saturated solutions in the copper sulfate + sulfuric acid + seawater system at different temperatures. Brazilian Journal of Chemical Engineering. 2015; 32(3): 629-635. Recuperado de doaj.org.
- Park, C.S. and Kim, B.G. (2016). In vitro Solubility of Copper(II) Sulfate and Dicopper Chloride Trihydroxide for Pigs. Asian Australas. J. Anim. Sci. 2016; 29(11): 1608-1615. Recuperado de doaj.org.
- U.S. National Library of Medicine. (2019). Copper sulfate pentahydrate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Wikipedia (2020). Chalcanthite. Recuperado de en.wikipedia.org.
