Ion hidronio: estructura, acidez, solvatación
¿Qué es el ion hidronio?
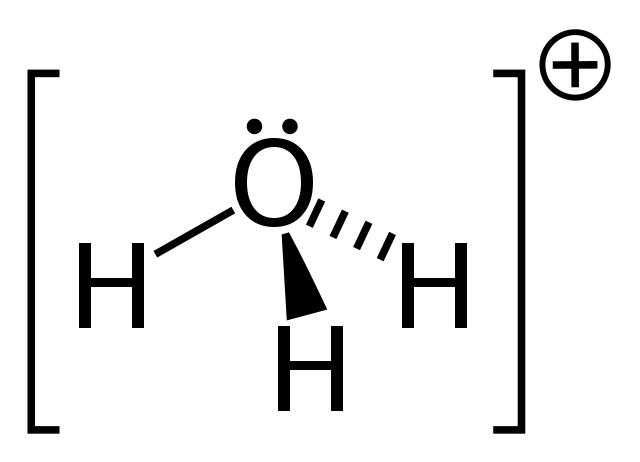
El ion hidronio es una especie de carga positiva que resulta de la protonación de una molécula de agua, y cuya fórmula química es H3O+. Consiste en el más simple de los oxonios: iones donde el oxígeno porta una carga formal positiva y tiene tres enlaces covalentes.
El H3O+ es uno de los cationes más simples pero curiosos que existen. En el agua bajo condiciones normales tiene una concentración de 1·10-7 M, producto del equilibrio de autoionización. Sin embargo, su concentración se incrementa exponencialmente cuando ácidos más fuertes que el mismo H3O+ se disuelven en el agua, acidificándola.
La concentración o actividad del H3O+ en el agua sirve para la medición de la acidez de las soluciones acuosas: pH. Mientras más iones H3O+ haya, menos positivo será el pH, y más ácida será la solución en cuestión. Esta acidez, por otro lado, reside en el ion hidrógeno, H+, el cual muchas veces se confunde con el ion H3O+.
El H+ y su asombrosa capacidad para transferirse entre los puentes de hidrógeno de las moléculas de agua le permite al H3O+ asociarse en formaciones catiónicas más complejas; tales como el catión de Eigen, H9O4+, y el catión de Zundel, H5O2+, y otros tantos.
Estructura del ion hidronio
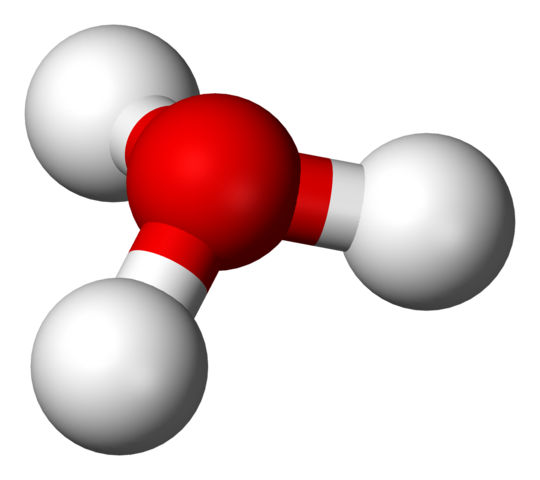
En la primera imagen se pudo ver la fórmula estructural del ion hidronio. Arriba ahora vemos su representación con un modelo de esferas y barras. En ambas resalta la geometría pirámide trigonal, cuyos ángulos de enlace (O-H) es de 113º; un poco desviado del 119º para el tetraedro.
Aunque el oxígeno tenga una carga parcial positiva, esto no quiere decir que la región negativa se sitúe alrededor de los átomos de hidrógeno. Todo lo contrario. El oxígeno en el H3O+ es todavía más electronegativo producto de su deficiencia electrónica; por lo que se concentrará sobre él toda la densidad negativa visualizada en un mapa de potencial electrostático:
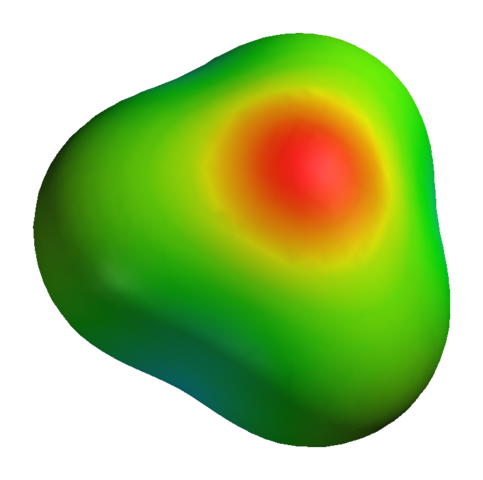
Sin mencionar que el oxígeno tiene un par de electrones libres, lo cual refuerza aún más dicha densidad negativa.
Una consecuencia de todo lo anterior es que los hidrógenos del H3O+ pierden densidad electrónica, pues el oxígeno la atrae hacia sí. Por lo tanto, el H3O+ puede establecer fuentes de hidrógeno muy fuertes con una molécula de agua vecina: H2O+-H—OH2.
Esta interacción es la clave detrás de la asombrosa movilidad iónica del H+ y del por qué el H3O+ es capaz de asociarse con muchas moléculas de agua a la vez.
Acidez
El ion hidronio es un ácido muy fuerte. De hecho, es el ácido más fuerte que puede existir en solución acuosa. ¿Por qué? Porque cualquier otro ácido más fuerte que él protonará una molécula de agua para originar H3O+:
HA + H2O → A– + H3O+
El H3O+ es capaz de mantenerse estable siempre que no haya otras bases en el medio que sean más fuertes que el agua. Cualquier ácido HA que cumpla con esto se catalogará como un ácido fuerte. Mientras, si el ácido HA es más débil que el H3O+, entonces parte de HA no se disociará por completo y hablaremos de un ácido débil:
HA + H2O ⇌ A– + H3O+
Por lo tanto, dado que el H3O+ es el ácido más fuerte que existe en el agua, la acidez de esta dependerá de la concentración del H3O+. Esta es la base para definir, en términos simples, la acidez de una solución acuosa expresada como pH:
pH = -log[H3O+]
H+ vs. H3O+
El ion hidrógeno y el hidronio no son lo mismo. El H+ es mucho más ácido que el H3O+, pues consiste en un protón nada más, el cual buscará por todos los medios enlazarse a una molécula para ganar electrones. Cuando el H+ consigue a una molécula de agua se forma el H3O+:
H+ + H2O → H3O+
Es por eso que el H3O+ puede representarse como H+(ac), indicando que es un H+ en medio acuoso.
La fuerza de un ácido se mide en su capacidad de donar, de acuerdo a la definición de Brönsted-Lowry, iones H+. Cuánto más fuerte sea, más donará H+, no H3O+. Los ácidos más fuertes jamás sintetizados (superácidos) son aquellos en donde prácticamente el H+ se encuentra “desnudo”; es decir, sin ningún impedimento para brincar hacia la molécula que protonará.
La práctica de representar al H3O+ como H+(ac) es tan común que muchas veces se habla de los dos como si fueran lo mismo, sin que eso repercuta negativamente en la interpretación de la química de las soluciones.
Solvatación
El H3O+ puede formar puentes de hidrógeno muy fuertes con una molécula de agua vecina. Al hacerlo, tenemos el catión de Zundel, H5O2+:
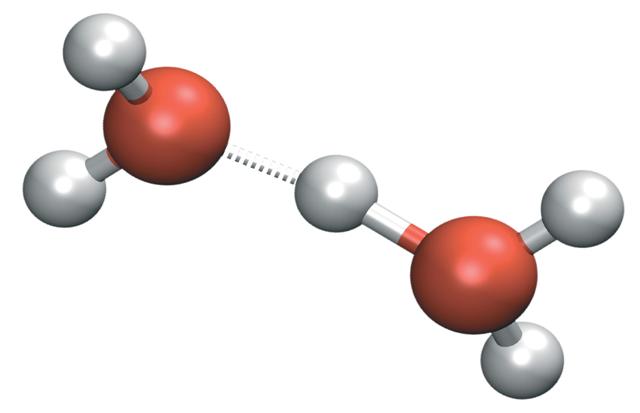
Pero la carga positiva no se queda solamente de un solo lado del catión: esta puede transferirse a la otra molécula de agua como ion H+:
H2O— H-+OH2 → H2O+-H— OH2
Por lo tanto, la carga positiva se distribuye entre ambos átomos de oxígeno para las dos moléculas de agua.
En el caso del catión de Eigen, H9O4+, un H3O+ forma puentes de hidrógeno con tres moléculas de agua, distribuyéndose entre todas ellas la carga positiva gracias a un “saltarín” H+. Estos brincos son tan rápidos, que explican la gran movilidad iónica del H+ en el agua, utilizando al H3O+ como vehículo, y a las moléculas de agua como una autopista.
El H5O2+ y H9O4+ no son las únicas asociaciones catiónicas que el H3O+ puede originar en el agua. Algunos cálculos de dinámica molecular demuestran la existencia de un clúster H3O+(H2O)20: 20 moléculas de H2O interaccionando con un catión H3O+ y distribuyendo entre ellas la carga positiva.
Por lo tanto, el H3O+ y H+ construyen una curiosa relación con las moléculas de agua, más allá de la acidez.
Sales
Así como existen las sales orgánicas de oxonio, no es excepción con el oxonio derivado de la protonación del agua. Su fórmula general es [H3O+][X–], donde X– es cualquier anión que provenga de la disolución de un ácido muy fuerte.
Estas sales reciben en ocasiones el nombre de ‘ácidos monohidratos’, ya que la fórmula [H3O+][X–] o H3O+·X– también puede escribirse como HX·H2O. Así, puede haber ácidos dihidratos, HX·2H2O, trihidratos, HX·3H2O, etc.
Por ejemplo, el HCl puede cristalizar como HCl·H2O o H3O+·Cl–. Asimismo, tenemos otras sales de hidronio como H3O+·ClO4– o HClO4·H2O, y HBr·4H2O o H3O+·Br–·3H2O.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Hydronium. Recuperado de: en.wikipedia.org
- Avneet Kahlon & Stephen Lower. (15 de agosto de 2020). The Hydronium Ion. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (25 de agosto de 2020). Hydronium Ion Definition. Recuperado de: thoughtco.com
- The Editors of Encyclopaedia Britannica. (2020). Hydrogen ion. Recuperado de: britannica.com
