Sistema termodinámico: propiedades, tipos, ejemplos
Un sistema termodinámico o sustancia de trabajo es una parte del universo que se escoge para ser estudiada por la termodinámica. Se trata de una definición muy amplia, porque un sistema termodinámico puede ser vasto como una galaxia o tratarse de una pequeña cantidad de gas contenido en un cilindro.
Todo aquello que rodea al sistema termodinámico, incluyendo masa y espacio, es el entorno o ambiente del mismo. No se trata del resto del universo, sino únicamente del entorno capaz de afectar al sistema.
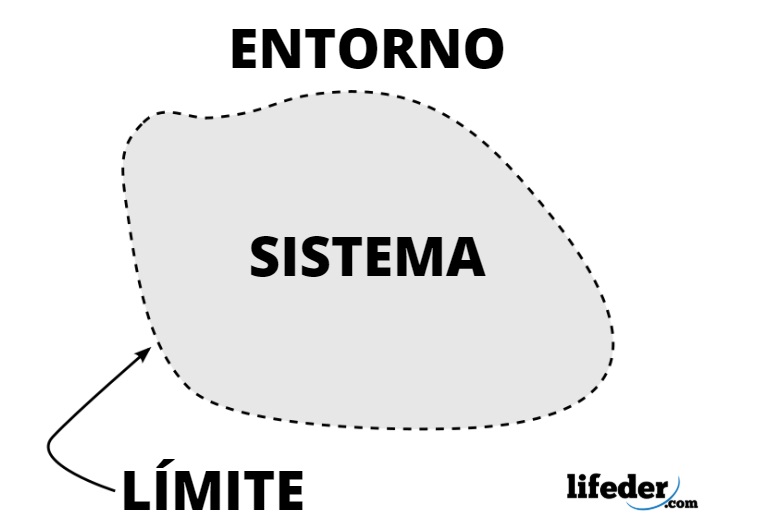
En un sistema termodinámico es posible el intercambio de masa o energía entre el sistema y los alrededores, dependiendo de la clase de sistema, siendo el entorno donde se ubican los observadores que lo estudian.
En el análisis de un sistema termodinámico es importante establecer las fronteras (límites o paredes), los cuales pueden ser fijos o móviles. Un frasco de vidrio o de metal tiene paredes fijas, pero un émbolo o pistón las tiene móviles.
Como tal, la frontera puede ser una superficie real o imaginaria, pero idealmente tiene espesor nulo, cierta rigidez y otras características que se describen en forma matemática.
Las fronteras imaginarias son necesarias al estudiar sistemas que a su vez forman parte de sistemas mucho mayores, como una estrella en una nebulosa.
Los intercambios de calor entre el sistema y su entorno, si los hay, son los objetivos primordiales de la termodinámica. Por eso se le da un nombre especial a las paredes que permiten el intercambio: adiabáticas, mientras que aquellas que no lo permiten y aíslan al sistema son diatérmicas.
Índice del artículo

Hay diversos tipos de sistemas termodinámicos, que se clasifican según su capacidad de intercambiar materia y energía con el entorno, de esta forma tenemos:
El intercambio de materia y energía con el exterior se permite, por esto también se les llama volumen de control.
Gran cantidad de sistemas en ingeniería se modelan de esta manera, por ejemplo los calentadores de agua caseros y los radiadores de los automóviles.
Se les conoce también como masa de control y se caracterizan porque no hay intercambio de materia con el ambiente. Por lo tanto su masa es fija, sin embargo la energía puede cruzar su límite, ya sea como calor o como trabajo. De esta forma el volumen del sistema puede variar.
Se trata de sistemas cerrados en los que se impide el intercambio de calor, trabajo o cualquier forma de energía con el entorno.
Los sistemas descritos se clasificaron de acuerdo a su capacidad de intercambio con el entorno, pero este no es el único criterio. Los sistemas termodinámicos también pueden ser homogéneos y heterogéneos.
Las sustancias puras son buenos ejemplos de sistemas homogéneos, como la sal de mesa guardada en el salero. Al contrario, una combinación de agua líquida y vapor de agua es un sistema heterogéneo, pues se trata de dos estados diferentes, cuyas propiedades difieren.
Como hemos podido ver, los sistemas termodinámicos van de lo más simple a lo más complejo. Sin embargo, a la hora de estudiarlos, es conveniente definirlos cuidadosamente y tratar de buscar todas las formas de simplificar el análisis.
Veamos algunos ejemplos de sistemas reales que nos acompañan en la cotidianidad:

Este es un sistema termodinámico muy sencillo e ilustrativo, y además una buena forma de preparar alimentos. El contenido del recipiente, ya sean huevos, una mezcla para un flan o la preparación que sea, es el sistema termodinámico, mientras que el baño de agua constituye el entorno o ambiente.
Al calentar el agua, el calor fluye hasta el sistema a través de la frontera del recipiente.
La rapidez con que se cocine el alimento depende de varios factores, uno de ellos es el material de la cacerola: si es de cerámica o de metal. Sabemos que el metal es un buen conductor del calor, así que esperamos que el contenido se caliente rápidamente si se utiliza una vasija de acero o aluminio.
Puede que en vez de calentar al sistema, se quiera enfriar, por ejemplo entibiar una botella de leche para bebé que se calentó en exceso. En este caso el sistema cede calor al baño de agua.

La cocina es un lugar excelente para encontrar procesos termodinámicos. Una salsa, pollo u otro alimento guisado en una sartén abierta, es un ejemplo de sistema abierto, ya que allí se permite todo tipo de intercambio con el entorno: agregar condimentos, otros ingredientes y modificar el calor que se añade.
En el motor de combustión interna de los autos, motocicletas, aviones y lanchas hay una mezcla de gas (aire) y combustible que se prepara en el carburador y es llevada al cilindro, donde por efecto de la combustión se convierte en una mezcla de gases varios.
Como la composición de la mezcla va variando a lo largo del ciclo de trabajo, se trata de un sistema termodinámico complejo y heterogéneo.

El café o el té se mantienen calientes por más tiempo en un termo. Se trata de un recipiente provisto de paredes aislantes, precisamente para evitar que nuestro sistema –la bebida caliente- entregue su calor al entorno y se enfríe.
Realmente un termo son dos recipientes, entre los cuales se hace vacío parcial para evitar la presencia de un medio como el aire, que ayude a conducir el calor desde el interior hasta fuera del recipiente.
Desde luego el termo también funciona a la inversa, sirve para mantener las bebidas frías por más tiempo.
Los huevos que consumimos como alimento son excelentes ejemplos de sistemas termodinámicos cerrados, pero que permiten el intercambio de energía con el entorno. La cáscara del huevo deja que el calor de la gallina empolle al embrión, así como el paso de los gases.
La célula es la unidad fundamental de los seres vivos y es un sistema termodinámico maravillosamente eficiente. Por extensión, cualquier ser vivo también puede ser considerado como un sistema termodinámico complejo.
La membrana celular que recubre las estructuras internas como el núcleo y la mitocondria es la frontera entre el sistema y el entorno. Esta permite el intercambio energético, la llegada de nutrientes desde el exterior y la salida de desechos.
Las comidas enlatadas son ejemplos típicos de sistemas termodinámicos cerrados.
El agua dentro del calentador es un sistema termodinámico abierto, ya que es necesario permitir que al agua le llegue calor, usualmente desde una resistencia eléctrica que se calienta, si el calentador es eléctrico, o mediante energía solar o la llama que proviene de un mechero a gas.
- Borgnakke. 2009. Fundamentals of Thermodynamics. 7th Edition. Wiley and Sons.
- Cengel, Y. 2012. Termodinámica. 7ma Edición. McGraw Hill.
- Energía Solar. Sistemas termodinámicos. Recuperado de: solar-energía.net.
- Wikipedia. Sistemas termodinámicos. Recuperado de: es.wikipedia.org.
- Wikipedia. Thermodynamic system. Recuperado de en.wikipedia.org.
