Ciclo de Carnot: etapas, aplicaciones, ejemplos, ejercicios
El ciclo de Carnot es la secuencia de procesos termodinámicos que tienen lugar en un motor de Carnot, un dispositivo ideal que consta solamente de procesos de tipo reversible; es decir, aquellos que habiendo tenido lugar, pueden retornar al estado inicial.
Este tipo de motor se considera ideal, puesto que carece de la disipación, roces o viscosidad que surgen en las máquinas reales, convirtiendo la energía térmica en trabajo utilizable, aunque la conversión no se lleva a cabo al 100%.

Un motor se construye partiendo de una sustancia capaz de hacer trabajo, como por ejemplo un gas, gasolina o vapor. A esta sustancia se la somete a diversos cambios de temperatura y a su vez experimenta variaciones en su presión y su volumen. De esta forma es posible mover un pistón dentro de un cilindro.
Índice del artículo
- 1 ¿En qué consiste el ciclo de carnot?
- 2 Etapas del ciclo de Carnot
- 3 El teorema de Carnot
- 4 Ejemplos
- 5 Ejercicios resueltos
- 6 Referencias
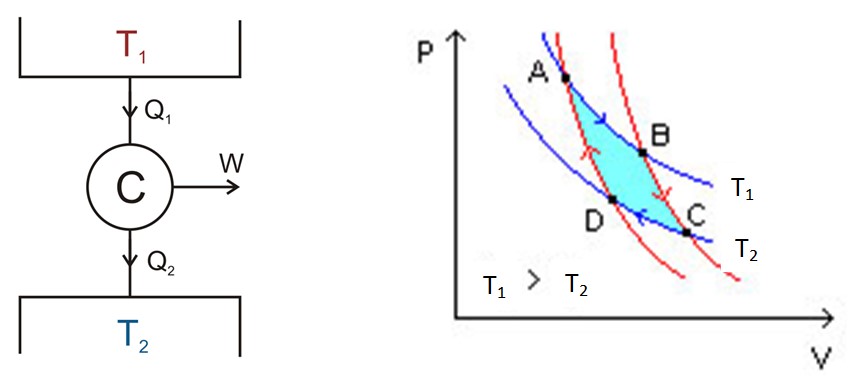
El ciclo de Carnot tiene lugar dentro de un sistema llamado motor de Carnot o C, el cual es un gas ideal encerrado en un cilindro y provisto de un pistón, que está en contacto con dos fuentes a distintas temperaturas T1 y T2 como el que se muestra en la siguiente figura a la izquierda.
Allí suceden los siguientes procesos a grosso modo:
- Se le suministra al dispositivo una cierta cantidad de calor Qentrada = Q1 desde el depósito térmico a alta temperatura T1.
- El motor de Carnot C realiza un trabajo W gracias a este calor suministrado.
- Una parte del calor utilizado: el desecho Qsalida, se transfiere al depósito térmico que está a menor temperatura T2.
El análisis se efectúa mediante un diagrama P-V (Presión –Volumen), tal como se muestra en la figura 2 (figura derecha). El objetivo del motor puede ser mantener frío el depósito térmico 2, extrayendo calor de él. En este caso se trata de una máquina refrigerante. Si por el contrario se quiere ceder calor al depósito térmico 1 entonces se trata de una bomba de calor.
En el diagrama P-V se muestran los cambios de presión – temperatura del motor bajo dos condiciones:
– Manteniendo la temperatura constante (proceso isotérmico).
– Sin transferencia de calor (aislamiento térmico).
Los dos procesos isotérmicos necesitan ser conectados, lo cual se logra mediante aislamiento térmico.
Se puede comenzar por cualquier punto del ciclo, en el cual el gas tiene unas ciertas condiciones de presión, volumen y temperatura. El gas sufre una serie de procesos y puede retornar a las condiciones de partida para comenzar otro ciclo, y siempre la energía interna final es la misma que la inicial. Puesto que la energía se conserva:
Trabajo hecho por C = Calor de entrada – Calor de salida
ΔW = Qentrada – Qsalida
El área comprendida dentro de este ciclo o lazo, en color turquesa en la figura, equivale precisamente al trabajo realizado por el motor de Carnot.
En la figura 2 están marcados los puntos A, B, C y D. Se comenzará por el punto A siguiendo la flecha de color azul.
La temperatura entre los puntos A y B es T1. El sistema absorbe calor del depósito térmico 1 y sufre una expansión isotérmica. Entonces el volumen aumenta y la presión disminuye.
Sin embargo la temperatura se mantiene en T1, puesto que cuando el gas se expande se enfría. Por tanto, su energía interna se mantiene constante.
En el punto B el sistema comienza una nueva expansión en la cual el sistema no gana ni pierde calor. Esto se consigue poniéndolo en aislamiento calórico como se ha indicado antes. Por lo tanto es una expansión adiabática que prosigue hasta el punto C siguiendo la flecha roja. El volumen aumenta y la presión disminuye hasta llegar a su valor más bajo.
Comienza en el punto C y finaliza en D. Se retira el aislamiento y el sistema entra en contacto con el depósito térmico 2, cuya temperatura T2 es menor. El sistema cede calor de desecho al depósito térmico, la presión comienza a aumentar y el volumen a disminuir.
Llegado al punto D, el sistema pasa nuevamente a aislamiento térmico, la presión aumenta y el volumen disminuye hasta llegar nuevamente a las condiciones originales del punto A. Entonces el ciclo se repite nuevamente.
El teorema de Carnot fue postulado por primera vez a comienzos del siglo XIX por el físico francés Sadi Carnot. En el año de 1824 Carnot, quien formaba parte del ejército francés, publicó un libro en el que propuso la respuesta a la siguiente cuestión: ¿bajo qué condiciones una máquina térmica tiene la máxima eficiencia? Carnot estableció entonces lo siguiente:
Ningún motor térmico funcionando entre dos depósitos térmicos es más eficiente que el motor de Carnot.
El rendimiento η de un motor térmico viene dado por el cociente entre el trabajo realizado W y el calor absorbido Q:
rendimiento = trabajo realizado/calor absorbido
De esta forma, el rendimiento de un motor térmico cualquiera I es: η = W/Q. Mientras que el rendimiento de un motor de Carnot R es η´ = W/Q´, en el supuesto de ambos motores sean capaces de realizar el mismo trabajo.
El teorema de Carnot afirma que η nunca es mayor que η´. De lo contrario se cae en contradicción con la segunda ley de la Termodinámica, según la cual es imposible un proceso en el cual el resultado sea que salga calor de un cuerpo de menor temperatura para ir a otro de mayor temperatura sin recibir ayuda externa. Por lo tanto:
η η‘
Para demostrar que esto es así, considérese al motor de Carnot actuando como máquina refrigeradora accionada por un motor I. Esto es posible ya que el motor de Carnot funciona mediante procesos reversibles, tal como se especificó al comienzo.
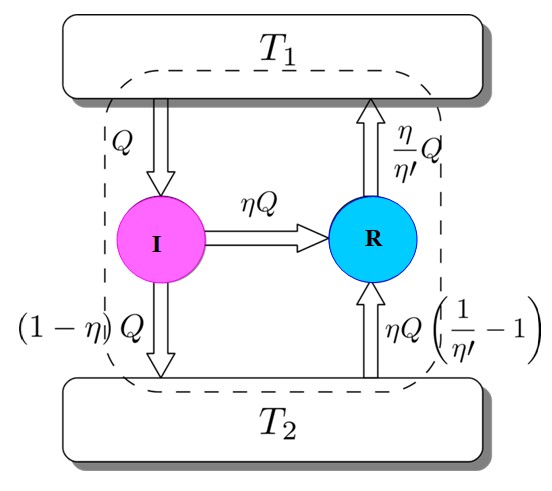
Se tiene a ambos: I y R trabajando con los mismos depósitos térmicos y se supondrá que η >η‘. Si en el camino se llega a una contradicción con la segunda ley de la termodinámica, el teorema de Carnot queda demostrado por reducción al absurdo.
La figura 3 ayuda a seguir el proceso. El motor I toma una cantidad de calor Q, el cual divide de esta manera: realizando trabajo sobre R equivalente a W= ηQ y el resto es el calor cedido (1-η)Q al depósito térmico T2.
Dado que la energía se conserva se cumple todo lo siguiente:
Eentrada = Q = Trabajo W + calor cedido a T2 = ηQ + (1-η)Q = Esalida
Ahora la máquina refrigeradora de Carnot R toma del depósito térmico 2 una cantidad de calor dada por:
(η / η´) (1-η´)Q =
La energía también se debe conservar en este caso:
Eentrada = ηQ + (η / η´) (1-η´)Q = (η / η´)Q =Q´ =Esalida
El resultado es la transferencia al depósito térmico T2 de una cantidad de calor dada por (η / η´) Q = Q´.
Si η es mayor que η´ significa que al depósito térmico de mayor temperatura ha llegado más calor del que I tomó originalmente. Puesto que ningún agente externo, tal como otra fuente térmica, ha participado, la única forma en que pudo suceder es que el depósito térmico más frío cediera el calor.
Esto está en desacuerdo con la segunda ley de la Termodinámica. Se concluye entonces que no es posible que η‘ sea menor que η, por tanto el motor I no puede tener más rendimiento que la máquina de Carnot R.
El corolario del teorema de Carnot afirma que dos máquinas de Carnot tienen la misma eficiencia si ambas operan con los mismos depósitos térmicos.
Eso significa que no importa la sustancia, el rendimiento es independiente y no puede elevarse cambiándola.
La conclusión del análisis anterior es que el ciclo de Carnot es el tope del proceso termodinámico idealmente alcanzable. En la práctica hay muchísimos factores que disminuyen la eficiencia, por ejemplo el hecho de que el aislamiento nunca es perfecto y en las etapas adiabáticas en realidad hay intercambio calórico con el exterior.
En el caso de un automóvil, el bloque del motor se calienta. Por otra parte la mezcla de gasolina y aire no se comporta exactamente como un gas ideal, que es el punto de partida del ciclo de Carnot. Esto por mencionar solamente algunos factores que provocarán una drástica reducción del rendimiento.
Si el sistema es un pistón encerrado en un cilindro como en la figura 4, el pistón sube durante la expansión isotérmica, como se aprecia en el primer esquema de la extrema izquierda y asimismo sube durante la expansión adiabática.
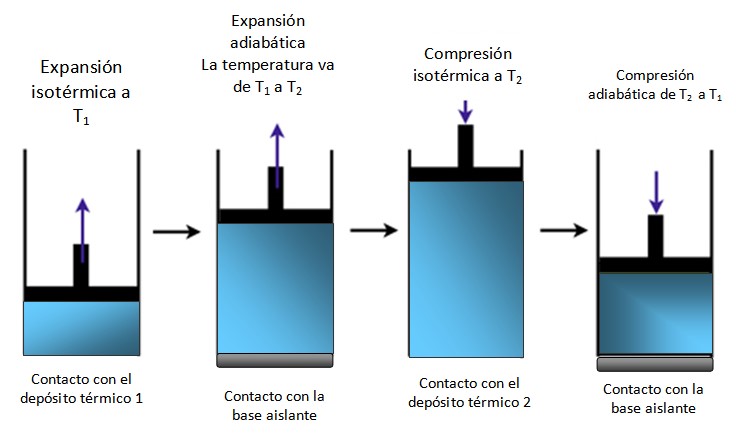
Luego se comprime isotérmicamente, cediendo calor, y sigue comprimiéndose adiabáticamente. El resultado es un movimiento en que el pistón sube y baja en el interior del cilindro y que puede transmitirse hacia otras partes de un dispositivo en particular, como un motor de automóvil por ejemplo, que produce un par, o bien una máquina de vapor.
Además de la expansión y compresión de un gas ideal en el interior de un cilindro, existen otros procesos reversibles ideales con los que se puede configurar un ciclo de Carnot, por ejemplo:
– Movimientos de ida y vuelta en ausencia de rozamientos.
– Un resorte ideal que se comprime y descomprime y que nunca se deforma.
– Circuitos eléctricos en los que no hay resistencias que disipen la energía.
– Ciclos de magnetización y desmagnetización en los que no existan pérdidas.
– Carga y descarga de una batería.
Si bien es un sistema muy complejo, una primera aproximación de lo que se requiere para producir energía en reactor nuclear es la que sigue:
– Una fuente térmica, consistente en un material que se desintegra radiactivamente como el uranio.
– El sumidero o depósito térmico frío que sería la atmósfera.
– La “máquina de Carnot” que utiliza un fluido, casi siempre agua corriente, al cual se le suministra calor desde la fuente térmica para convertirla en vapor.
Cuando el ciclo se lleva a cabo se obtiene energía eléctrica a modo de trabajo neto. Al ser transformada en vapor a alta temperatura, el agua se hace llegar hasta una turbina, donde la energía se transforma en energía de movimiento o cinética.
La turbina a su vez acciona un generador eléctrico que transforma la energía de su movimiento en energía eléctrica. Además de material fisionable como el uranio, por supuesto se pueden utilizar combustibles fósiles como fuente de calor.
La eficiencia de una máquina térmica se define como el cociente entre el trabajo de salida y el trabajo de entrada, y por lo tanto es una cantidad adimensional:
Eficiencia máxima = (Qentrada – Q salida) /Qentrada
Denotando la eficiencia máxima como emáx, es posible demostrar su dependencia de la temperatura, que es la variable más fácil de medir, como:
emáx =1 – (T2/T1)
Donde T2 es la temperatura del sumidero y T1 es la temperatura de la fuente térmica. Como esta última es mayor, la eficiencia siempre resulta ser menor que 1.
Supóngase que se tiene una máquina térmica capaz de funcionar de los siguientes modos: a) Entre 200 K y 400 K, b) Entre 600 K y 400 K. ¿Cuál es la eficiencia en cada caso?
Solución
a) En el primer caso la eficiencia es:
emax1 = 1 – (200/400) = 0.50
b) Para el segundo modo la eficiencia será:
emax2 = 1- (400/600) = 0.33
Aunque la diferencia de temperatura es la misma entre ambos modos, la eficiencia no lo es. Y más notable aún es que el modo con mayor eficiencia opera a temperatura más baja.
Una máquina térmica con eficiencia de 22 % produce 1530 J de trabajo. Encontrar: a) La cantidad de calor absorbida del depósito térmico 1, b) La cantidad de calor desechado al depósito térmico 2.
a) En este caso se utiliza la definición de eficiencia, ya que se dispone del trabajo realizado, no de las temperaturas de los depósitos térmicos. Un 22% de eficiencia significa que e max = 0.22, por lo tanto:
Eficiencia máxima = Trabajo /Qentrada
La cantidad de calor absorbida es precisamente Qentrada, así que despejando se tiene:
Qentrada = Trabajo/Eficiencia = 1530 J/0.22 = 6954.5 J
b) La cantidad de calor cedido al depósito más frío se encuentra a partir de ΔW = Qentrada – Qsalida
Qsalida = Qentrada – ΔW = 6954.5 -1530 J = 5424.5 J.
Otra forma es a partir de emáx =1 – (T2/T1). Como no se conocen las temperaturas, pero estas están relacionadas con el calor, la eficiencia también se puede expresar como:
emáx =1 – (Qcedido/Qabsorbido)
- Bauer, W. 2011. Física para Ingeniería y Ciencias. Volumen 1. Mc Graw Hill. 654-657
- Energía nuclear. Funcionamiento de una central nuclear. Recobrado de: energia-nuclear.net
- Serway, R., Jewett, J. (2008). Física para Ciencias e Ingeniería. Volumen 1. 7ma. Ed. Cengage Learning. 618-622.
- Tippens, P. 2011. Física: Conceptos y Aplicaciones. 7ma Edición. MacGraw Hill. 414-416.
- Walker, J.2008. Physics. 4th Ed.Addison Wesley. 610-630
