Sólidos cristalinos: estructura, propiedades, tipos, ejemplos
Los sólidos cristalinos son aquellos cuyas estructuras microscópicas son ordenadas y obedecen un patrón distintivo para una determinada red cristalina; por ejemplo: cúbica, hexagonal, triclínica, romboédrica, entre otras.
Se dice que estos sólidos existen como cristales, los cuales muestran facetas y diseños geométricos que reflejan cuán ordenados son por dentro. Otros ejemplos de sólidos cristalinos son el diamante, el cuarzo, el antraceno, el hielo seco, el cloruro de potasio o el óxido de magnesio.

Un par de sólidos cristalinos altamente conocido es el del azúcar y la sal (NaCl). A simple vista, ambos lucen cristales blancos; pero sus propiedades difieren enormemente. El azúcar es un sólido cristalino molecular, mientras la sal un sólido cristalino iónico. El primero está compuesto de moléculas de sacarosa; y el segundo, de iones Na+ y Cl–.
La imagen superior permite vislumbrar lo brillantes que pueden ser unos cristales de azúcar. Los cristales de sal sin embargo no se quedan atrás. Aunque el azúcar y la sal parezcan hermanos, sus estructuras son diferentes: el azúcar, que viene a ser sacarosa, tiene una estructura monoclínica; mientras que la sal, una estructura cúbica.

El azúcar y la sal pulverizados (glas) siguen siendo cristalinos; sus cristales solo se han vuelto mucho más pequeños para nuestros ojos. La cristalinidad de un sólido, por lo tanto, se define más por su estructura interna, que por su apariencia externa o sus brillos.
Índice del artículo
- 1 Estructura de los sólidos cristalinos
- 2 Propiedades
- 3 Tipos de sólidos cristalinos
- 4 Ejemplos
- 5 Referencias
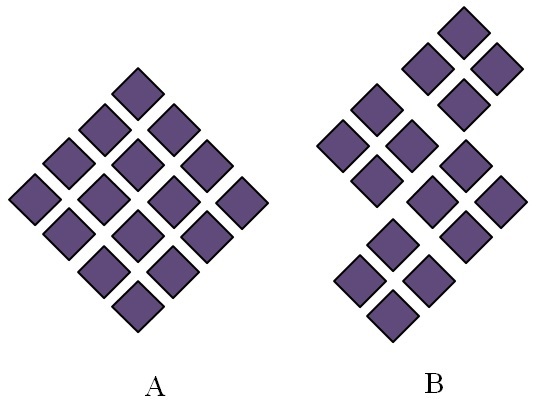
Los sólidos cristalinos tienen estructuras ordenadas. Sus características geométricas dependerán del tipo de red cristalina a la que pertenecen, la cual a su vez se proyecta exteriormente en las formas del cristal (sistema cristalino). La imagen superior ilustra dos conceptos importantes de tales estructuras: periodicidad y granos cristalinos.
El ordenamiento espacial de las partículas de un sólido cristalino es periódico; esto es, se repite una y otra vez en todas direcciones. Esto origina un patrón estructural propio para cada sólido y red cristalina; por ejemplo, es aquí donde la sal y el azúcar comienzan a diferenciarse más allá de su naturaleza química.
En A los rombos se ordenan para dar lugar a un rombo de mayores proporciones. Cada rombo morado representa una partícula o un conjunto de las mismas (átomos, iones o moléculas). Así, pudiera esperarse que un cristal macroscópico de A tenga una apariencia romboédrica.
Mientras, en B los rombos se ordenan de tal modo que originan granos cristalinos; estos son, cristales muy pequeños (cristalitos). Se dice entonces que B es un sólido policristalino; es decir, está formado por la aglomeración múltiples cristalitos.
En conclusión, un sólido puede ser simplemente cristalino (A), o policristalino (B); A forma cristales, mientras B policristales.
Las propiedades de los sólidos cristalinos dependen de su tipo de cristal. Se sabe ya que sus estructuras son ordenadas, y que además suelen presentar brillantes facciones que enamoran a los amantes de los minerales. No obstante, se hizo mención de que un sólido polvoriento, inclusive “apagado”, también puede catalogársele como cristalino.
El modo en que se orientan espacialmente sus partículas les permite tener algunas propiedades importantes para su caracterización. Por ejemplo, los sólidos cristalinos son capaces de difractar los rayos X, creando espectros de difracción a partir de los cuales puede determinarse la estructura microscópica de un cristal.
Asimismo, debido a que la estructura es periódica, el calor se difunde de igual modo a través de todo el sólido; siempre y cuando no haya impurezas de por medio. Así, los puntos de fusión para un sólido cristalino son constantes, y no varían sin importar cómo se midan.
Los tipos de sólidos cristalinos se basan en qué tipo de partículas lo componen y cuáles son sus interacciones o enlaces. Los hay en esencia de cuatro tipo: iónicos, metálicos, moleculares y redes covalentes.
Aun cuando presenten cierto grado de impurezas, continúan siendo cristalinos, a pesar de que sus propiedades se vean afectadas y no muestren los mismos valores esperados para un sólido puro.
La sal es un ejemplo de un sólido cristalino iónico, pues está compuesto de iones Na+ y Cl–. Por lo tanto, en este tipo de sólidos gobierna el enlace iónico: son las fuerzas electrostáticas las que rigen el ordenamiento estructural.
Todos los átomos metálicos forman cristales metálicos. Esto significa que, por ejemplo, un tenedor de plata es un conglomerado de cristales de plata fusionados. La estructura interna o microscópica es la misma en cada palmo del objeto, y permanece inalterada desde el mango del tenedor hasta la punta de sus dientes.
El azúcar es un ejemplo de un sólido cristalino molecular, pues está formado de moléculas de sacarosa. Por lo tanto, este tipo de sólido se compone de moléculas, que mediante sus interacciones intermoleculares (y no enlaces covalentes) logran establecer una estructura ordenada.
Por último, tenemos los sólidos cristalinos de redes covalentes. En ellos predominan los enlaces covalentes, pues son los responsables de establecer un orden y mantener los átomos fuertemente fijados en sus respectivas posiciones espaciales. No se habla de iones, átomos o moléculas, sino de redes tridimensionales.
A continuación, y para finalizar, se citarán algunos ejemplos para cada uno de los tipos de sólidos cristalinos.
Todas las sales son sólidos iónicos. Asimismo, hay sulfuros, hidróxidos, óxidos, haluros, y otros compuestos que también están formados por iones, o sus interacciones son en esencia iónicas. Tenemos pues:
-KCl
-CaSO4
-Ba(OH)2
-CuSO4
-FeCl3
-Na2S
-MgO
-CaF2
-NaHCO3
-(NH4)2CrO4
Además de estos ejemplos, la inmensa mayoría de los minerales se consideran sólidos cristalinos iónicos.
Cualquier elemento metálico se presenta naturalmente como cristales metálicos. Algunos de ellos son:
-Cobre
-Hierro
-Aluminio
-Cromo
-Hidrógeno metálico (bajo inimaginables presiones)
-Tungsteno
-Circonio
-Titanio
-Magnesio
-Sodio
Existen una gran variedad de sólidos cristalinos moleculares. Prácticamente cualquier compuesto orgánico que solidifique logra establecer cristales si su pureza es elevada, o si su estructura no es demasiado intrincada. Así pues tenemos:
-Hielo (H2O)
-Hielo seco (CO2)
-I2
-P4
-S8 (y sus polimorfos)
-Antraceno
-Oxígeno sólido
-Amoníaco sólido
-Fenolftaleína
-Ácido benzoico
Y finalmente, entre algunos sólidos cristalinos de redes covalentes tenemos:
-Diamante
-Grafito
-Nanotubos de carbono
-Fullerenos
-Cuarzo
-Silicio
-Germanio
-Nitruro de boro
De esta lista, los nanotubos de carbono y los fullerenos también pudieran considerarse como sólidos cristalinos moleculares. Esto se debe a que, si bien constan de átomos de carbonos unidos covalentemente, definen unidades que pueden visualizarse como macromoléculas (balones de fútbol y tubos).
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Crystal. Recuperado de: en.wikipedia.org
- Chemistry LibreTexts. (16 de junio de 2019). Crystalline and Amorphous Solids. Recuperado de: chem.libretexts.org
- Rachel Bernstein & Anthony Carpi. (2020). Properties of Solids. Recuperado de: visionlearning.com
