Aggregatibacter actinomycetemcomitans: características, morfología, cultivo
Aggregatibacter actinomycetemcomitanses una bacteria perteneciente a la familia Pasteurellaceae y forma parte del grupo de microorganismos de crecimiento lento denominado (HACEK). No es la única especie de este género pero si es una de las más importantes. Antiguamente este microorganismo fue clasificado como un Actinobacillus.
Esta bacteria, al igual que la especie A. aphrophilus, están presentes en la microbiota oral de humanos y primates y ha sido asociada a procesos infecciosos graves y recurrentes en la cavidad oral, tal como la periodontitis agresiva o crónica.
Sin embargo, también se ha visto involucrada en infecciones extra orales, entre las que se pueden mencionar: endocarditis, bacteriemia, infecciones de heridas, abscesos subfrénicos, abscesos cerebrales, osteomielitis mandibular, entre otras.
La mayoría de las infecciones extra orales se deben a una invasión del microorganismo desde la cavidad oral hacia el interior. Esto ocurre por la destrucción progresiva que causa este microorganismo en los tejidos que conforman el periodonto de inserción y de protección, produciendo una infección por contigüidad.
Afortunadamente, la mayoría de las veces esta bacteria es susceptible a tetraciclina y a otros antibióticos. Sin embargo, ya se han reportado cepas resistentes a tetraciclina, debido a la presencia del plásmidos tetB.
Índice del artículo
- 1 Historia
- 2 Taxonomía
- 3 Características generales
- 4 Factores de virulencia
- 5 Morfología
- 6 Hábitat
- 7 Cultivo
- 8 Patogenia
- 9 Tratamiento
- 10 Prevención
- 11 Referencias
Klinger, en 1912, aisló por primera vez a este microorganismo, quien lo llamó Bacterium actinomycetum comitans.En 1921 el nombre fue reducido a Bacterium comitans por Lieske.
Ocho años después, el nombre fue nuevamente modificado, pero esta vez por Topley y Wilson quienes lo denominaron Actinobacillus actinomycetemcomitans. En 1985 Potts lo reclasifica al género Haemophilus (H. actinomycetemcomitans).
Posteriormente, gracias a un estudio de ADN realizado en el 2006 por Neils y Mogens, se crea un nuevo género llamado Aggregatibacter., en el cuál fue incluido este microorganismo y lo denominaron Aggregatibacter actinomycetemcomitans, siendo su nombre actual.
De igual manera, otras bacterias que anteriormente estaban en el género Haemophilus, tales como: Haemophilus aphrophilus, H. paraphrophilus y H. segnis, fueron reclasificadas y encajadas en este nuevo género, debido a su similitud genética.
Si desglosamos el nombre de la especie actinomycetemcomitans, podemos observar que se trata de una combinación de vocablos.
El término actes significa rayo, refiriéndose a la forma estrellada que presenta la colonia de este microorganismo sobre el agar.
La palabra mycetes significa hongo. Este término fue incluido debido a que antiguamente los actinomicetos eran considerados hongos.
Finalmente, la palabra comitans significa ‘común’, expresando la íntima relación entre el Actinobacillus y el Actinomycetem, originando en ocasiones infecciones en conjunto.
Reino: Bacteria
Filo: Proteobacteria
Clase: Gammaproteobacteria
Orden: Pasteurellales
Familia: Pasteurellaceae
Género: Aggregatibacter
Especie: actinomycetemcomitans.
Existen 5 serotipos bien definidos de este microorganismo. Estos son designados con las letras a, b, c, d y e según la composición del antígeno O.
Hay otros serotipos que no han podido ser tipificados. Se sabe que el serotipo (b) es el más virulento y el más frecuentemente aislado de las lesiones de periodontitis agresiva en personas provenientes de EE.UU., Finlandia y Brasil.
En tanto que, el segundo serotipo más frecuente es el (c), el cual se ha encontrado principalmente en pacientes provenientes de China, Japón, Tailandia y Corea. Este serotipo se ha aislado con mayor frecuencia en lesiones extra orales.
Los factores de virulencia se pueden dividir en aquellos elementos que influyen para favorecer la colonización, los que modifican la respuesta inmune, los que favorecen la destrucción de los tejidos e invasión y los que inhiben la reparación de los tejidos.
La producción de un material amorfo extracelular de naturaleza proteica, junto con la capacidad de adherencia que le confieren sus fimbrias y la producción de adhesinas liberadas en sus vesículas, juegan un papel fundamental en la formación de biopelículas (biofilms) y por ende de la colonización.
Es por ello que, este microorganismo es capaz de adherirse fuertemente a ciertas superficies, tales como: vidrio, plástico e hidroxiapatita, así como entre sí mismos.
Su principal factor de virulencia está representado por la hiperproducción de una leucotoxina, almacenadas y liberadas por vesículas citoplasmáticas. Como su nombre lo indica, la leucotoxina presenta una gran actividad citotóxica sobre los leucocitos (polimorfonucleares y macrófagos).
Cabe destacar que las vesículas también liberan endotoxinas y bacteriocinas. Las endotoxinas estimulan la producción de citoquinas proinflamatorias, mientras que las bacteriocinas actúan inhibiendo el crecimiento de otras bacterias, creando un desequilibrio en la microbiota oral a su favor.
Similar a la leucotoxina se encuentra la toxina de distensión citoletal, o también llamada citotoxina distensora del citoesqueleto (CDT).
Esta exotoxina tiene la capacidad de bloquear el crecimiento, distorsionar la morfología e impedir el buen funcionamiento de los linfocitos CD4. También es posible que active el proceso de apoptosis (muerte celular programada) de estas células. De esta manera la respuesta inmune se ve debilitada.
La respuesta inmune también se ve afectada debido a la inhibición del proceso de opsonización, ya que las fracciones Fc de los anticuerpos son atraídos por ciertas proteínas ubicadas en la pared celular del microorganismo.
Esta unión evita que el complemento haga su función. Además de esto hay inhibición en la síntesis de anticuerpos IgM e IgG.
Finalmente, esta bacteria también produce sustancias que inhiben la atracción quimiotáctica de los leucocitos, especialmente de los polimorfonucleares, así como también evita la producción de peróxido de hidrógeno en estas mismas células.
La capacidad de destrucción e invasión de tejidos que posee este microorganismo está principalmente dada por la producción de epiteliotoxinas, colagenasas y de una proteína denominada GROE1.
Las primeras destruyen las uniones intercelulares a nivel de los hemidesmosomas, las segundas destruyen el tejido conectivo del periodonto y la tercera tiene actividad osteolítica (destrucción del hueso).
Para empeorar el cuadro no se puede pasar por alto la presencia del lipopolisacárido (LPS) en su pared celular (endotoxina).
El LPS actúa como un estimulante para la producción de interleuquina 1 (IL-1B), factor de necrosis tumoral alfa (FNT-α), entre otros mediadores inflamatorios, además de favorecer la reabsorción ósea.
Por otra parte, hay que destacar que hay indicios de que esta bacteria puede vivir y multiplicarse intracelularmente, especialmente dentro de las células epiteliales.
La invasión a las células se da en sitios específicos, tales como el tejido conectivo, en el hueso alveolar, en los espacios intracelulares, entre otros.
Además de todo lo mencionado anteriormente esta bacteria también produce otras citotoxinas que retrasan la renovación del tejido dañado, al destruir a los fibroblastos, generándose un verdadero caos.
Es un cocobacilo Gram negativo que no posee flagelos, por tanto es inmóvil. No forma esporas pero si posee cápsula y fimbrias. Cada bacteria mide aproximadamente entre 0.3-0.5 µm de ancho y 0.6-1.4 µm de largo.
En el Gram puede observarse cierto pleomorfismo, es decir, algunos individuos se presentan más alargados (cocobacilos) y otros más cortos (cocoides), predominando las formas cocobacilares sobre las cocáceas cuando el Gram proviene de un medio de cultivo.
Mientras que predominan las formas cocáceas cuando proviene de una muestra directa, se distribuyen de forma aislada, en pares o formando grumos o racimos.
Aggregatibacter actinomycetemcomitans se desarrolla en colonias transparentes, rugosas de forma redondeadas y bordes sutilmente dentados.
Patognomónicamente en su centro se observa una figura de mayor densidad en forma de estrella. Esta característica es apreciable especialmente en cultivos que han tenido una incubación prolongada.
Se cree que esta figura es formada por la presencia de fimbrias. Otra característica importante es que las colonias se adhieren fuertemente al agar, siendo difícil su remoción.
Este microorganismo habita en la cavidad oral como microbiota local. Mientras este se encuentre en equilibrio con el resto de los microorganismos no causa problema, pero un aumento en su población puede iniciar la destrucción del periodonto.
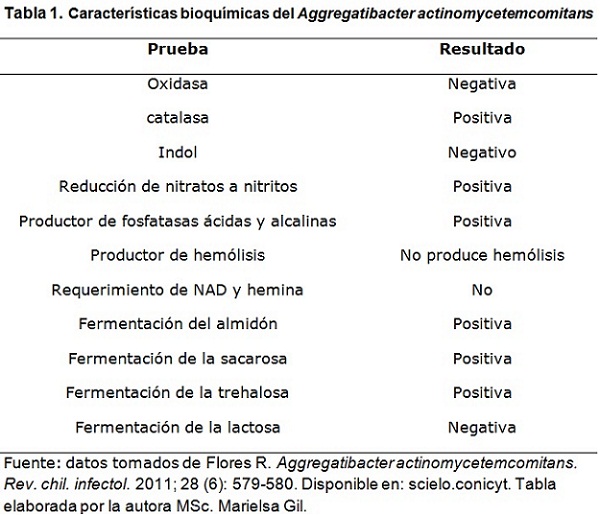
Es un microorganismo anaerobio facultativo, que se caracteriza por ser capnofílico, es decir, en presencia de oxígeno requiere un ambiente con 5-10% de CO2 para ser cultivado. También crece en condiciones de anaerobiosis estricta.
Su crecimiento en medios de cultivos es lento, por tanto, en los medios sólidos se observarán colonias bien definidas después de transcurrir entre 48 a 72 horas de incubación. Crece a temperatura de 37 °C.
Este microorganismo siendo Gram negativo no crece en agar MacConkey. Esta bacteria requiere ciertos nutrientes que son proporcionados por el medio de cultivo tripticasa de soya, suero de caballo, bacitracina y vancomicina (TSBV).
La adición de extractos de levadura o cisteína al medio puede mejorar aún más su recuperación.
Para realizar la prueba de susceptibilidad a los antibióticos se utiliza agar Müeller Hinton sin ningún aditivo.
Este microorganismo es un patógeno oportunista. Cuando están dadas las condiciones se comporta como una bacteria muy virulenta, pudiendo causar graves daños e incluso puede llevar a la muerte.
Se sabe que inicia el proceso de destrucción de los tejidos que conforman el periodonto.
Es por ello que, el A. actinomycetemcomitans es considerado un periodontopatógeno junto a otras bacterias, tales como: Phorphyromonas gingivalis, Fusobacterium nucleatum, Prevotella intermedia,Treponema denticola, Prevotella nigrescens, Tannerella forsythensis, Campylobacter rectus y Peptoestreptococcus micros, entre otros.
Algunos estudios han revelado la presencia de varios patógenos de forma conjunta en la enfermedad periodontal. La presencia de A. actinomycetemcomitans junto a Phorphyromonas gingivalis, es de mal pronóstico.
La destrucción del tejido progresa rápidamente, pudiendo originar lesiones de contigüidad importantes, tales como: abscesos cerebrales, abscesos hepáticos, glomerulonefritis, infecciones pleuropulmonares, linfadenitis cervical, entre otras afecciones.
Puede llegar a la sangre y producir endocarditis, bacteriemias, artritis séptica, endoftalmitis, absceso epidural e infecciones en la cavidad intra-abdominal (abscesos subfrénicos).
Los casos de endocarditis están asociados a la presencia de una malformación o condición previa en el paciente, como por ejemplo la presencia de valvulopatías o válvulas protésicas. Por otra parte, esta bacteria aumenta el riesgo de infartos, ya que engrosa la placa ateromatosa en las arterias coronarias.
En pacientes con periodontitis se puede usar como tratamiento local (cavidad oral) buches con clorhexidina al 0.12 – 0.2%, 2 veces al día por 10-14 días.
En el tratamiento de la periodontitis es importante realizar un destartraje supra gingival y sub gingival (sobre y debajo de la encía respectivamente) y además un pulido radicular para alisar la superficie, pues sobre una superficie lisa es más difícil que se acumule el sarro.
Sin embargo, esto no es suficiente y se necesita un tratamiento sistémico con antibióticos, tales como ciprofloxacina, metronidazol, amoxicilina o tetraciclina.
Se recomienda el uso de combinaciones de antimicrobianos para una erradicación de la bacteria más eficiente. Las combinaciones de amoxicilina y metronidazol o ciprofloxacina con metronidazol han sido de gran utilidad, no así la de metronidazol con doxiciclina, según algunos estudios realizados.
Esta cepa por lo general expresa resistencia frente a penicilina, ampicilina, amikacina y macrólidos.
Para prevenir una infección por este microorganismo se recomienda cuidar y mantener una buena salud bucal. Para ello es necesario acudir periódicamente al odontólogo y eliminar la placa dental y el sarro con limpiezas frecuentes.
El hábito de fumar es un factor que favorece la enfermedad periodontal, motivo por el cual se debe evitar.
- Ramos D, Moromi H, Martínez E, Mendoza A. Aggregatibacter actinomycetemcomitans: Patógeno importante en la periodontitis. Odontol.Sanmarquina. 2010; 13 (2):42-45. Disponible en: Users/Equipo/Downloads/
- Flor-Chávez M, Campos-Mancero O. Susceptibilidad antibiótica del Aggregatibacter actinomycetemcomitans por medio del test de difusión y dilución. Dom. Cien. 2017; 3 (2): 348-374. Disponible en: Dialnet.com
- Raja M, Ummer F, Dhivakar CP. Aggregatibacter actinomycetemcomitans – a tooth killer? J Clin Diagn Res. 2014; 8 (8):13–16. Available from: ncbi.nlm.nih.gov/
- Malheiros V, Avila-Campos M. Aggregatibacter actinomycetemcomitans y Fusobacterium nucleatum en biopelículas subgingivales de pacientes brasileños con y sin enfermedad periodontal: comparación de dos métodos de detección. Odontol.Sanmarquina 2018; 21(4): 268-277. Disponible en: docs.bvsalud.org/
- Ardila C, Alzate J, Guzmán I. Asociación de Aggregatibacter actinomycetemcomitans y microorganismos del complejo rojo con parámetros clínicos de pacientes con periodontitis crónica. AMC, 2010; 14 (3). Disponible en: scielo.sld
- Díaz J, Yáñez J, Melgar S, Álvarez C, Rojas C, Vernal R. Virulencia y variabilidad de Porphyromonas gingivalis y Aggregatibacter actinomycetemcomitans y su asociación a la periodontitis. Rev. Clin. Periodoncia Implantol. Rehabil. Oral. 2012; 5 (1): 40-45. Disponible en: scielo.
- Flores R. Aggregatibacter actinomycetemcomitans. Rev. chil. infectol. 2011; 28 (6): 579-580. Disponible en: scielo.conicyt
