Óxido de etileno: estructura, propiedades, riesgos y usos
El óxido de etileno es un compuesto orgánico de la familia de los epóxidos. A temperatura ambiente es gaseoso, incoloro y, aunque es casi inodoro, presenta un suave olor dulce, similar al de los éteres.
Es un bloque de construcción química muy versátil, ya que es usado en una gran variedad de aplicaciones industriales para la manufactura de otros compuestos químicos con múltiples usos. Esto se debe a su alta reactividad, es decir, a su facilidad para reaccionar con otras sustancias.
Una de sus principales aplicaciones es como materia prima en la fabricación de los componentes de los anticongelantes para radiadores de vehículos. Sus derivados son empleados como ingredientes de limpiadores industriales o del hogar, productos cosméticos y champús, plastificantes, preparaciones farmacéuticas o ungüentos.
Es un desinfectante muy utilizado, por ejemplo, en la esterilización de equipos médicos y dentales, ya que es capaz de destruir virus, bacterias, hongos y esporas, especialmente en condiciones secas. Además, se ha utilizado para fumigar productos alimenticios para su empacado, aunque este uso está cuestionado.
A pesar de su utilidad, debe manipularse con suma precaución, pues puede causar irritación de los ojos y de la piel. La inhalación de óxido de etileno por largos períodos puede afectar el sistema nervioso. Por lo tanto, las personas que estén expuestas a sus vapores o soluciones deben utilizar equipos y ropa de protección.
Índice del artículo
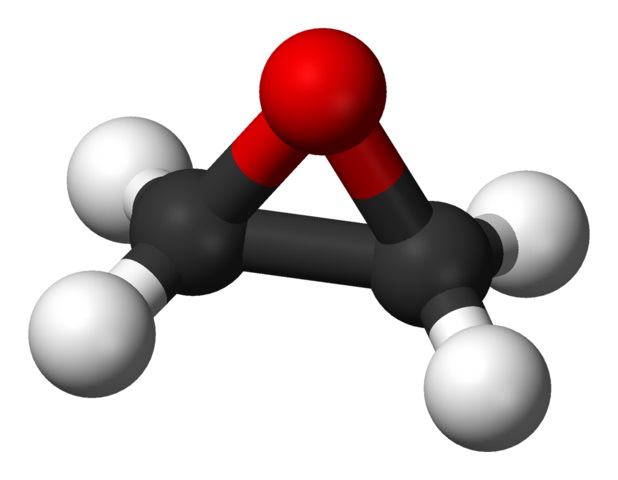
Su fórmula molecular es C2H4O. Pertenece al grupo de los epóxidos, siendo el más simple y el más importante de éstos. Tiene la forma de un anillo de tres miembros.
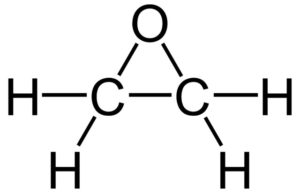
Debido a su estructura de anillo triangular, el óxido de etileno es muy reactivo, lo cual se debe a la facilidad con que se abre el anillo. En promedio, los ángulos de enlace son de 60º, lo que hace que sus enlaces sean débiles. La molécula es menos estable que la de un éter lineal y tiende a reaccionar con facilidad con otros compuestos químicos.
– Oxirano.
– Epoxietano.
A temperatura ambiente y bajo presión atmosférica, es un gas. Por debajo de 10,6 ºC y bajo presión atmosférica, es un líquido. Por debajo de -111 ºC es un sólido.
44,05 g/mol.
Menor a 0 ºF (-17,8 ºC).
Su densidad es menor que la del agua, siendo de 0,882 a 10 ºC. A su vez, sus vapores son más pesados que el aire.
Es soluble en agua, benceno, acetona, etanol y éter. Es miscible con tetracloruro de carbono.
428,9 ºC.
– Si se somete a calentamiento o contaminación puede polimerizar exotérmicamente (produciendo gran cantidad de calor). Si la polimerización ocurre dentro de un recipiente, este puede romperse violentamente.
– Puede reaccionar con materiales oxidantes.
– Es extremadamente tóxico, carcinógeno y buen generador de mutaciones en bacterias y en células de mamíferos.
A escala industrial se prepara mediante la oxidación del etileno con el oxígeno (O2) del aire. La velocidad de esta reacción se aumenta con la presencia del metal plata (Ag) y la acción de la temperatura. A continuación, se muestra la reacción:
Ag, 250ºC
2C2H4 + O2 ———————> 2C2H4O
Etileno Óxido de etileno
– Se ha reportado que produce desórdenes neurológicos y que puede causar la muerte. La menor concentración que puede generar efectos tóxicos por inhalación es de 12.500 ppm/10 segundos (ppm significa: partes por millón).
– Es un fuerte irritante de la piel, de los ojos y del tracto respiratorio.
– La exposición a vapores con alta concentración de óxido de etileno puede causar irritación de los ojos, inflamación de la membrana del ojo y daño en la córnea.
– Se ha llegado a asociar el desarrollo de cataratas a la exposición a sus vapores y las salpicaduras. Con soluciones concentradas se producen un daño severo en los ojos.
– El contacto de soluciones acuosas de óxido de etileno con la piel produce irritación y puede conducir a dermatitis severa con ampollas y quemaduras.
– Su inhalación puede afectar el sistema nervioso, causando dolores de cabeza y náuseas, entre otros síntomas.
– Cuando se expone a una llama o al calor hay peligro de explosión. Cuando se calienta se generan vapores peligrosos.
– El vapor forma mezclas explosivas con el aire en un amplio rango de concentraciones.
– Se debe evitar manipularlo con equipos que contengan metales como cobre, plata, mercurio, magnesio, aluminio u óxidos de hierro, así como evitar agentes como el amoniaco, agentes oxidantes, ácidos o bases orgánicas, entre otros. Todos estos materiales pueden acelerar su polimerización y/o explosión.
Es usado como intermediario en la producción de otros químicos, que a su vez son empleados en la manufactura de fibras de poliéster para ropa, tapicería, alfombras y almohadas.
Con el óxido de etileno se produce el etilenglicol que se emplea en los anticongelantes para motores de vehículos. El etilenglicol también se usa en la manufactura de la fibra de vidrio y de películas de plástico para empaquetado.
Otros químicos producidos a partir del óxido de etileno incluyen surfactantes no-iónicos empleados en detergentes y fórmulas para lavar los platos.
Se usa como agente esterilizante de equipos médicos, tales como instrumentos quirúrgicos, agujas e inyectadoras hipodérmicas o prótesis.
También se emplea para esterilizar máquinas para hemodiálisis, equipos de laboratorio, instrumentos dentales, instrumentos veterinarios, termómetros, ropa quirúrgica o equipos de primeros auxilios, entre otros.

A pesar de que existen varios métodos disponibles para la esterilización de equipos médicos, en algunos usos ningún tratamiento disponible puede reemplazar al óxido de etileno.
Este es el caso de la esterilización de ciertos materiales sensibles al calor y a la radiación, así como algunos instrumentos y artefactos que requieren esterilización en el propio sitio de uso en hospitales.
En estos lugares, el óxido de etileno se emplea para controlar pestes como los hongos e insectos. Sin embargo, este uso no es tan corriente y se emplea cuando otras alternativas no son efectivas.
Se ha empleado como pesticida, fungicida, fumigante, herbicida, insecticida, rodenticida, entre otras variantes. Reduce significativamente la población de bacterias y hongos en especias.
Sin embargo, debido a preocupaciones de seguridad y ambientales, el uso de óxido de etileno para fumigación de alimentos ha sido prohibida en la Unión Europea y en los Estados Unidos.
- U.S. National Library of Medicine. (2019). Ethylene Oxide. Recuperado de pubchem.ncbi.nlm.nih.gov
- Chemical Safety Facts. (2019). Ethylene Oxide. Recuperado de chemicalsafetyfacts.org
- Morrison, Robert Thornton; and Boyd, Robert Neilson. 1992. Organic Chemistry. Prentice-Hall.
- Moerman, F. and Mager, K. (2016). Cleaning and Disinfection in Dry Food Processing Facilities. In Handbook of Hygiene Control in the Food Industry (Second Edition). Recuperado de sciendirect.com.
- Eastmond, David A. and Balakrishnan, Sharada. (2010). Genotoxicity of Pesticides. In Hayes’ Handbook of Pesticide Toxicology (Third edition). Recuperado de sciencedirect.com
- Atungulu, G.G. and Pan, Z. (2012). Microbial decontamination of nuts and spices. In Microbial Decontamination in the Food Industry. Recuperado de sciencedirect.com
