Clorito de sodio (NaClO2): estructura, propiedades, usos, riesgos
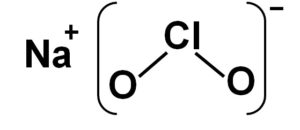
El clorito de sodio es un sólido inorgánico formado por un ion sodio Na+ y un ion clorito ClO2–. Su fórmula química es NaClO2. Es un sólido blanco cristalino, además de ser un agente oxidante fuerte. Por ello debe ser manipulado con mucho cuidado.
Su principal uso es como agente desinfectante para muchas aplicaciones. Permite eliminar microbios en superficies como pisos, paredes y equipos de laboratorio en hospitales y clínicas y en sus sistemas de agua.

También en instalaciones agrícolas y veterinarias, para higienizar incubadoras de huevos de aves, para controlar las infecciones de las ubres de las vacas lecheras, para desinfectar los sistemas de agua para los animales, etc.
En la industria alimenticia sus soluciones acuosas acidificadas sirven para lavar carnes, pollos, frutas, vegetales, así como los equipos de tales instalaciones.
Con el clorito de sodio se puede preparar dióxido de cloro ClO2 en el sitio de uso, el cual permite eliminar microbios, malos olores y sabores del agua para que esta sea agradable y se pueda beber sin problemas.
También sirve para blanquear pulpa de papel, fibras textiles vegetales y aceites, entre otras aplicaciones.
El NaClO2 sólido debe manejarse con precaución, pues en contacto con ciertos materiales pueden ocurrir explosiones. Sus soluciones son un poco más fáciles de manipular pero son muy oxidantes y corrosivas.
Índice del artículo
El clorito de sodio está formado por un catión sodio Na+ y un anión clorito ClO2– por lo tanto están unidos por un enlace iónico.
El anión clorito posee un átomo de cloro en un estado de oxidación de +3 y dos átomos de oxígeno con valencia -2 cada uno. Por esta razón el anión clorito posee una carga negativa.
Además posee una estructura en forma de ángulo.
– Clorito de sodio
– Clorito sódico
– Sal sódica del ácido cloroso
Sólido blanco cristalino.
90,44 g/mol.
Se descompone a medida que se funde entre 180 y 200 ºC.
2,468 g/cm3
Soluble en agua: 64 g/100 g de agua a 17 ºC. Ligeramente soluble en metanol.
Es ligeramente higroscópico.
Es un agente oxidante fuerte. Reacciona violentamente con materiales combustibles y reductores. Reacciona violentamente con ácidos, generando dióxido de cloro ClO2.
Sus soluciones alcalinas (significa en presencia de por ejemplo NaOH) son bastante estables, mientras que en medio ácido se forma el ácido cloroso HClO2, el cual se descompone de forma rápida:
4 HClO2 → 2 ClO2↑ + ClO3– + Cl– + 2 H+ + H2O
Tanto el NaClO2 sólido como sus soluciones acuosas son potencialmente peligrosos y requieren mucha precaución y experiencia durante su manipulación y almacenamiento.
El NaClO2 sólido puede explotar al entrar en contacto con sustancias orgánicas incluyendo guantes y ropa, materiales para controlar derrames como aserrín y algodón de desecho, así como aceites y grasas.
La forma sólida es por lo tanto muy difícil de transportar y se prefiere usarlo en forma de soluciones acuosas.
Estas soluciones son sumamente corrosivas. Deben mantenerse preferiblemente a un pH por encima de 8, esto es, un pH alcalino.
El NaClO2 acelera la combustión de compuestos o materiales inflamables, hasta el punto de que puede formar mezclas explosivas con estos.
Si se calienta emite humos tóxicos de ácido clorhídrico HCl y óxido de sodio Na2O. Si se expone de forma prolongada a calor o fuego puede explotar.
Se prepara comenzando con la reducción química o electroquímica de clorato de sodio NaClO3, en presencia de ácido clorhídrico HCl para producir dióxido de cloro ClO2.
Este último se hace reaccionar con peróxido de hidrógeno H2O2 en solución acuosa de hidróxido de sodio NaOH y se obtiene una solución de clorito de sodio NaClO2, la cual se evapora y se cristaliza el sólido.
También se puede obtener haciendo pasar el gas dióxido de cloro ClO2 por una solución de NaOH.
2 ClO2 + 2 NaOH → NaClO2 + NaClO3 + H2O
Es un ingrediente de numerosos productos que sirven para el control de bacterias, hongos y lodos o limos de algas. Los productos que lo contienen para este fin se emplean en agricultura, comercio, industria y residencias u hogares.
Sirve como desinfectante de muchos tipos de materiales y superficies.
En agricultura, industrias avícolas y similares se desinfectan superficies duras, equipos, instalaciones para la incubación de huevos de aves, invernaderos para hongos como champiñones, y sistemas de agua de enfriamiento y agua para corrales de aves.
Tiene uso veterinario como desinfectante tópico en el control de la mastitis del ganado lechero, para sumergir los pezones del animal. La mastitis es una infección de las ubres de las vacas.

Se emplea también en establecimientos de investigaciones naturales para descontaminar los laboratorios.
Los usos comerciales, industriales y médicos incluyen desinfectar sistemas de ventilación, superficies duras (como por ejemplo, pisos, paredes, equipos de laboratorio) y sistemas de agua.
En las instalaciones para el cuidado de la salud como clínicas y hospitales se usa para descontaminar salas, pasillos, zonas de aislamiento y para la esterilización de materiales.
También es útil para higienizar en establecimientos donde las personas se someten a tratamientos de salud con agua o spa.
En la industria alimenticia se utiliza como fumigante para conservar alimentos.
Se usa en forma de clorito de sodio acidificado. Este se produce añadiendo ácido grado alimenticio (por ejemplo, ácido cítrico, ácido fosfórico, ácido málico o sulfato ácido de sodio) a una solución acuosa de clorito de sodio.
El clorito de sodio acidificado tiene propiedades antimicrobianas y se usa como rocío o solución de lavado o remojo de pollo, carnes, vegetales, frutas y productos del mar. También en agua para congelar pollo o aves.
En los hogares permite desinfectar superficies duras, como pisos y baños, sistemas de calefacción o de aire acondicionado y sistemas de circulación de agua de piscinas.


Se expende también en pequeñas bolsitas junto con otros compuestos para liberar gas y controlar olores en los hogares.
Se usa en la purificación de agua para beber, actúa como oxidante, mejorando el sabor y el olor del agua potable.
El clorito de sodio es muy utilizado como precursor para la generación del dióxido de cloro ClO2 que sirve para tratar agua potable para el consumo humano, es decir, para eliminar microorganismos, olores y sabores desagradables y se pueda beber.
Para generar el ClO2 se puede emplear HCl:
5 NaClO2 + 4 HCl → 4 ClO2↑ + 5 NaCl + 2 H2O
El ClO2 es un agente antimicrobiano de alta acción oxidante y de amplio espectro. Esto es, actúa contra una gran cantidad de microorganismos.
Los microorganismos se desactivan porque el ClO2 interfiere con enzimas importantes de estos y con las proteínas de las membranas celulares. Además tiene la ventaja de que no produce compuestos organoclorados, los cuales son tóxicos.
Existen a la venta tabletas de clorito de sodio mezclado con otros compuestos las cuales se disuelven en el agua y producen inmediatamente el ClO2 de forma controlada, desinfectando así el agua.

El principal problema de tratar el agua para remover sabores y olores mediante ClO2 consiste en que se pueden formar sales tóxicas de clorito y clorato durante el tratamiento.
El NaClO2 es un componente de las soluciones que sirven para desinfectar los lentes de contacto.
Se usa una combinación de NaClO2 y trazas (muy pequeñas cantidades) de peróxido de hidrógeno H2O2.
El H2O2 estabiliza al ClO2 que se forma y la combinación de ambos es muy efectiva contra bacterias, hongos y levaduras. Los productos que resultan luego son cloruro de sodio NaCl, agua y oxígeno, los cuales son inocuos, lo que significa que no son dañinos para el ojo.
Cuando los lentes se remueven de la solución, el NaClO2 residual se descompone rápidamente en NaCl y O2. El peróxido residual no irrita el ojo. Por lo tanto estas soluciones son muy seguras.

El clorito de sodio es emplea para la preparación de dióxido de cloro ClO2 para su uso inmediato en gran cantidad de aplicaciones de las cuales algunas se trataron en párrafos anteriores.
Sirve para blanquear pulpa de madera, textiles como el algodón, fibras vegetales, aceites comestibles y no comestibles, grasas, barnices, lacas y ceras.
Es un componente de las gotas para los ojos y de algunas soluciones para lavados bucales.
Se emplea en la industria de procesamiento de cuero y en agentes para electrodeposición de metales (recubrimiento de metales).
- Williams, L. et al. (2019). Microbiology, Lens Care and Maintenance. In Contact Lenses (Sixth Edition). Recuperado de sciencedirect.com.
- U.S. National Library of Medicine. (2019). Sodium chlorite. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Gray, N.F. (2014). Chlorine Dioxide. Process Technology. In Microbiology of Waterborne Diseases (Second Edition). Recuperado de sciencedirect.com.
- McKeen, L. (2012). Introduction to Food Irradiation and Medical Sterilization. Chlorine dioxide. In The Effect of Sterilization on Plastic and Elastomers (Third Edition). Recuperado de sciencedirect.com.
- Ortenberg, E. and Telsch, B. (2003). Taste and odour problems in potable water. In Handbook of Water and Wastewater Microbiology. Recuperado de sciencedirect.com.
- Karsa, D.R. (2007). Biocides. Chlorine Dioxide. In Handbook for Cleaning/Decontamination of Surfaces. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. VCH Verlagsgesellschaft mbH.
