Test Voges-Proskauer: fundamento, preparación y usos
El test Voges-Proskauer es una prueba bioquímica que se utiliza para ayudar a la identificación de bacterias pertenecientes a la familia Enterobacteriaceae. Especialmente es útil para diferenciar cepas de Escherichia coli de Klebsiella y Enterobacter, entre otras.
La prueba se realiza en el medio de cultivo líquido llamado rojo de metilo–Voges Proskauer, mejor conocido con las siglas RM/VP. Este medio está compuesto por polipeptona tamponada, glucosa, fosfato dipotásico y agua destilada.

El medio actual RM/VP es una modificación del medio Clark y Lubs, el cual originalmente contenía menor concentración de peptonas y glucosa. Por tanto, se producía menos cantidad del ion hidrógeno, requerido para la reacción positiva de Voges-Proskauer.
El test se fundamenta en la capacidad que tiene el microorganismo de utilizar la glucosa por la vía butilén-glicólica, y formar un producto final neutro denominado acetoína, en presencia de oxígeno y de un pH alcalino.
En el medio RM/VP, además de poderse revelar el test de Voges-Proskauer, también se puede revelar la prueba de rojo de metilo.
Índice del artículo
- 1 Fundamento
- 2 Preparación
- 3 Procedimiento del test Voges-Proskauer
- 4 Uso
- 5 Control de calidad
- 6 Referencias
Las pluripeptonas presentes en el medio proporcionan los requerimientos nutricionales indispensables para el crecimiento bacteriano. Por su parte, la glucosa es el compuesto principal. Muchas bacterias tienen la capacidad de metabolizar la glucosa y formar ácido pirúvico.
El ácido pirúvico es un punto medio en el metabolismo de la glucosa y a partir de allí cada microorganismo puede tomar diferentes vías. Algunos formarán ácidos mixtos, tales como ácido láctico, ácido acético, ácido fórmico y ácido succínico, y otros formaran productos neutros como el 2,3-butanediol.
El test Voges-Proskauer revela la capacidad del microorganismo de formar acetil metil carbinol (acetoína), producto intermediario del 2,3-butanediol en condiciones de aerobiosis.
La acetoína se reduce y forma 2,3-butanediol, pero esta reacción es reversible, por tanto si el 2,3-butanediol se oxida se forma acetoína. Por ello, el oxígeno es indispensable.
El fosfato dipotásico es el buffer que amortigua la mezcla a un pH 6,9 ± 0,2.
Para evidenciar la reacción se debe realizar un revelado utilizando dos reactivos (reactivos de Barrit), conocidos como Voges A y Voges B.
El Voges A es una solución al 5% de α-naftol, y el Voges B es un preparado de hidróxido de potasio al 40%. Si no se dispone de hidróxido de potasio puede ser sustituido por hidróxido de sodio al 40%.
El α-naftol es un catalizador que aumentará la intensidad del color de la reacción, lo que hace a la prueba más sensible. El α-naftol debe agregarse siempre primero, agitando el tubo para que el medio entre en contacto con el oxígeno. De esta manera la acetoína presente se oxida a diacetilo, y el 2,3-butanediol se oxida para formar acetoína, pasando esta a diacetilo.
Es así como el α-naftol se unirá al diacetilo, que a su vez se ha unido al núcleo guanidina presente en el aminoácido arginina, esta última proveniente de las pluripeptonas.
Por su parte, el hidróxido de potasio o de sodio se encarga de absorber el CO2 y de reaccionar con las peptonas. Esta reacción origina la formación de un color rosado-salmón, claramente visible después de agitar muy bien el tubo.
Para que la coloración se produzca instantáneamente se deben mezclar cantidades correctas de diacetilo, peptona y α-naftol. Si esto no ocurre se deja reposar el tubo durante 15 minutos antes de interpretar.
Generalmente la prueba da positiva después de 2 a 5 minutos, cuando se puede observar un color rosado débil. Si se deja en reposo durante 30 min a 1 hora la intensidad del color será máxima (rojo intenso).
Una prueba negativa se pondrá en evidencia cuando el caldo quede de color amarillo. Después de 1 hora, si la prueba es negativa, se puede formar un color cobrizo producto de la reacción del hidróxido de potasio sobre el α-naftol.
Pesar 17 gr del medio de cultivo deshidratado y disolver en un litro de agua destilada. Dejar reposar por 5 minutos. Calentar hasta ebullición para disolver completamente. Servir 3 a 4 ml en tubos y esterilizar en autoclave a 121°C por 15 minutos.
El medio de cultivo deshidratado es de color beige y el medio preparado es de color ámbar claro.
El pH final del medio es de 6,9 ± 0,2.
Pesar 5 gr de α-naftol y disolver en 50 ml de alcohol etílico (absoluto). Posteriormente seguir agregando alcohol etílico hasta enrasar a 100 ml.
Pesar 40 gr de hidróxido de potasio y disolver en 50 ml de agua destilada en un beaker. El vaso debe colocarse en un baño de agua fría para controlar la temperatura, debido a que al momento de disolver la preparación sube de temperatura bruscamente.
Después de que la solución esté fría se trasvasa a un balón aforado y se enrasa a 100 mL con agua destilada.
Para realizar el test de Voges-Proskauer se inocula un caldo RM/VP con el microorganismo en estudio, a partir de un cultivo puro de 18 a 24 horas.
El inóculo no debe ser muy denso. Se incuba a 35-37°C por 24 a 48 horas, aunque en ocasiones es necesaria la incubación por varios días. Cowan y Steel opinan que 5 días es el tiempo mínimo de incubación necesario para detectar todas las especies Voges-Proskauer (VP) positivo de la familia Enterobacteriaceae.
Separar una alícuota de 1 mL en un tubo y realizar el revelado de la siguiente manera: coloque 12 gotas (0,6 mL) del reactivo Voges A y 4 gotas (0,2 ml) de Voges B. Mezcle para airear y deje reposar por 5 – 10 minutos antes de interpretar. Sin embargo, si la prueba aún está negativa deje reposar y observe el tubo al cabo de 30 minutos a 1 hora.
La aparición de un color rosado-rojo indica que la reacción Voges-Proskauer es positiva. Si el medio se queda amarillo la reacción es negativa.
La adición de los reveladores en el orden y cantidad indicada es fundamental para evitar falsos negativos.
La prueba de Voges-Proskauer es útil para diferenciar entre cepas de E. coli que son VP negativos, de los géneros Klebsiella, Enterobacter, Serratia, entre otros, que son VP positivos.
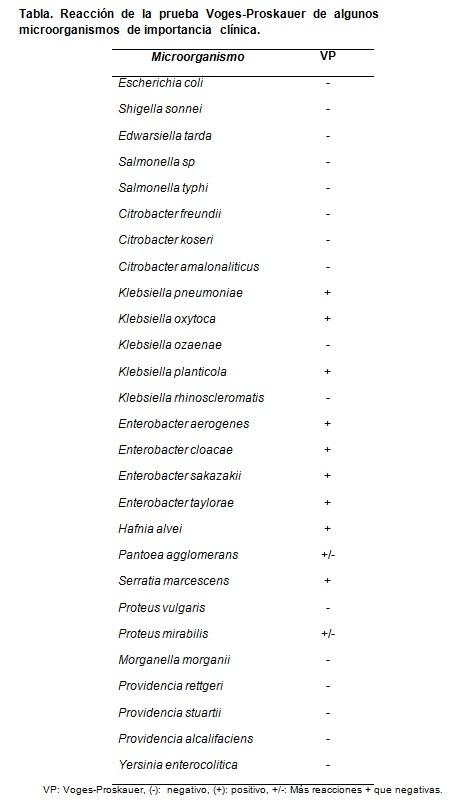
Para probar la calidad del medio preparado se pueden usar cepas controles, entre ellas Escherichia coli ATCC 25922, Klebsiella pneumoniae ATCC 700603, Proteus mirabilis ATCC 43071, Salmonella typhimurium y Enterobacter cloacae ATCC 13047.
Los resultados esperados son reacciones Voges-Proskauer positivas únicamente para K. pneumoniae y E. cloacae. El resto dan reacciones negativas.
- Laboratorios Britania. MR-VP Medio. 2015. Disponible en: www.britanialab.com
- Laboratorios Microkit. M-Ident Voges Proskauer. 2014. Disponible: http://www.medioscultivo.com
- Mac Faddin J. (2003). Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3era ed. Editorial Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
