Hafnio: qué es, estructura, propiedades, usos, riesgos

¿Qué es el hafnio?
El hafnio es un metal de transición cuyo símbolo químico es Hf y tiene un número atómico de 72. Es el tercer elemento del grupo 4 de la tabla periódica, siendo congénere del titanio y circonio. Con este último comparte muchas propiedades químicas, siendo localizados juntos en minerales de la corteza terrestre.
Buscar al hafnio es mirar hacia donde el circonio, pues es un subproducto de su extracción. El nombre de este metal proviene de la palabra latina ‘hafnia’, cuyo significo viene a ser el nombre de Copenhague, ciudad donde se le descubrió en minerales de circón y se puso fin a la controversia respecto a su verdadera naturaleza química.
Este metal se lleva la distinción de ser el último de los elementos más estables descubiertos aquí en la Tierra; es decir, los demás descubrimientos han constituido una serie de elementos ultrapesados, radiactivos y/o de isótopos artificiales.
Los compuestos del hafnio son análogos a los de titanio y circonio, predominando en ellos el número de oxidación de +4, tales como el HfCl4, HfO2, HfI4 y HfBr4. Algunos de ellos lideran la lista de los materiales más refractarios jamás creados, así como aleaciones de gran resistencia térmica y que actúa además como absorbentes excelentes de neutrones.
Por esta razón el hafnio tiene mucha participación en la química nuclear, especialmente a lo que respectan los reactores de agua a presión.
Descubrimiento
Metal de transición o de las tierras raras
El descubrimiento del hafnio estuvo rodeado de controversias, pese a que su existencia ya se predecía desde 1869 gracias a la tabla periódica de Mendeleev.
El problema radicó en que se posicionaba debajo del circonio, pero coincidía en el mismo período de los elementos de las tierras raras: los lantanoides. Los químicos por entonces no sabían si se trataba de un metal de transición o de un metal de las tierras raras.

El químico francés Georges Urbain, descubridor del lutecio, metal vecino del hafnio, aseguró en 1911 haber descubierto el elemento 72, al cual llamó celtio y proclamaba que era un metal de las tierras raras. Pero tres años más tarde se llegó a la conclusión de que sus resultados estaban equivocados, y que solo había aislado una mezcla de lantanoides.
No fue sino hasta que los elementos se ordenaron por sus números atómicos, gracias al trabajo de Henry Moseley en 1914, que se puso en evidencia la vecindad entre el lutecio y el elemento 72, concordando con las predicciones de Mendeleev al ubicarse este último elemento en el mismo grupo que los metales titanio y circonio.
Detección en Copenhague
En 1921, tras los estudios de la estructura atómica de Niels Bohr y su predicción del espectro de emisión de rayos X para el elemento 72, se dejó de buscar este metal en los minerales de las tierras raras; y en su lugar, se enfocó su búsqueda en los minerales de circonio, ya que ambos elementos debían de compartir varias propiedades químicas.
El químico danés Dirk Coster y el químico húngaro Georg von Hevesy en 1923 lograron finalmente reconocer el espectro predicho por Niels Bohr en muestras de circón provenientes de Noruega y Groenlandia. Al haber realizado el descubrimiento en Copenhague, llamaron al elemento 72 por el nombre latino de esta ciudad: hafnia, del cual derivó luego ‘hafnio’.
Aislamiento y producción
No obstante, no era tarea fácil separar los átomos de hafnio de los del circonio, ya que sus tamaños son similares y reaccionan del mismo modo. Si bien en 1924 se había ideado un método por recristalización fraccionada para obtener tetracloruro de hafnio, HfCl4, fueron los químicos holandeses Anton Eduard van Arkel y Jan Hendrik de Boer quienes lo redujeron al hafnio metálico.
Para ello, el HfCl4 se sometía a una reducción utilizando magnesio metálico (proceso Kroll):
HfCl4 + 2 Mg (1100 °C) → 2 MgCl2 + Hf
Por otro lado, partiendo del tetrayoduro de hafnio, HfI4, este se vaporizaba para sufrir una descomposición térmica sobre un filamento incandescente de tungsteno, sobre el cual se depositaba el hafnio metálico para originar una barra de apariencia policristalina (proceso de la barra cristalina o proceso Arkel- De Boer):
HfI4 (1700 °C) → Hf + 2 I2
Estructura del hafnio
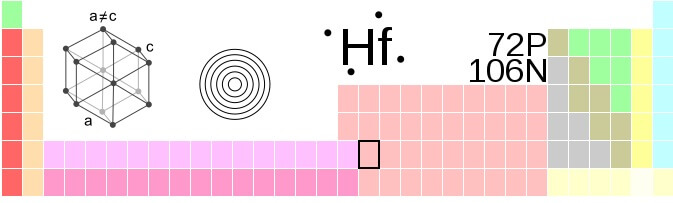
Los átomos de hafnio, Hf, se agrupan a presión ambiente en un cristal de estructura hexagonal compacta, hcp, al igual que lo hace los metales titanio y circonio. Este cristal hcp de hafnio viene a ser su fase α, la cual se mantiene constante hasta una temperatura de 2030 K, cuando sufre una transición a la fase β, de estructura cúbica centrada en el cuerpo, bcc.
Esto se entiende si se considera que el calor “relaja” el cristal y, por ende, los átomos Hf buscan posicionarse de tal modo que disminuya su compactación. Estas dos fases bastan para considerar el polimorfismo del hafnio.
Asimismo, presenta un polimorfismo que depende de las altas presiones. Las fases α y β existen a una presión de 1 atm; mientras que la fase ω, hexagonal pero aún más compactada que la hcp ordinaria, aparece cuando las presiones sobrepasan los 40 GPa. Curiosamente, cuando las presiones siguen aumentando, reaparece la fase β, la menos densa.
Propiedades del hafnio
Apariencia física
Sólido blanco plateado, el cual muestra tonalidades oscuras si tiene una capa de óxido y nitruro.
Masa molar
178,49 g/mol
Punto de fusión
2233 ºC
Punto de ebullición
4603 ºC
Densidad
A temperatura ambiente: 13,31 g/cm3, siendo dos veces más denso que el circonio
Justo en el punto de fusión: 12 g/cm3
Calor de fusión
27,2 kJ/mol
Calor de vaporización
648 kJ/mol
Electronegatividad
1,3 en la escala de Pauling
Energías de ionización
Primera: 658,5 kJ/mol (Hf+ gaseoso)
Segunda: 1440 kJ/mol (Hf2+ gaseoso)
Tercera: 2250 kJ/mol (Hf3+ gaseoso)
Conductividad térmica
23,0 W/(m·K)
Resistividad eléctrica
331 nΩ·m
Dureza de Mohs
5,5
Reactividad
A menos que el metal se pula y arda, despidiendo chispas a una temperatura de 2000 ºC, no tiene susceptibilidad por oxidarse ni corroerse, ya que una fina capa de su óxido lo protege. En este sentido, es uno de los metales más estables. De hecho, los ácidos ni las bases fuertes pueden disolverlo; a excepción del ácido fluorhídrico, y de los halógenos capaces de oxidarlo.
Configuración electrónica
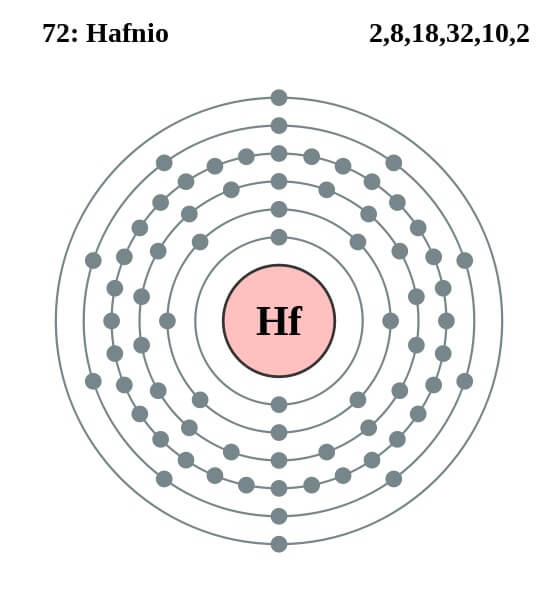
El átomo de hafnio tiene la siguiente configuración electrónica:
[Xe] 4f14 5d2 6s2
Esta coincide con el hecho de pertenecer al grupo 4 de la tabla periódica, junto con el titanio y circonio, porque posee cuatro electrones de valencia en los orbitales 5d y 6s. Asimismo nótese que el hafnio no podía tratarse de un lantanoide, ya que tiene sus orbitales 4f completamente llenos.
Números de oxidación
La misma configuración electrónica revela cuántos electrones es capaz de perder teóricamente un átomo de hafnio al formar parte de un compuesto. Suponiendo que pierde sus cuatro electrones de valencia, quedaría como un catión tetravalente Hf4+ (en analogía al Ti4+ y Zr4+), y tendría por tanto un número de oxidación de +4.
Este es de hecho el más estable y común de sus números de oxidación. Otros de ellos menos relevantes son: -2 (Hf2-), +1 (Hf+), +2 (Hf2+) y +3 (Hf3+).
Isótopos
El hafnio se presenta en la Tierra como cinco isótopos estables y uno radiactivo con un tiempo de vida muy grande:
–174Hf (0,16%, con un tiempo de vida media de 2·1015 años, por lo que se le considera prácticamente estable)
–176Hf (5,26%)
–177Hf (18,60%)
–178Hf (27,28%)
–179Hf (13,62%)
–180Hf (35,08%)
Nótese que no hay como tal ningún isótopo que destaque en abundancia, y esto se refleja en la masa atómica promedio del hafnio, 178.49 uma.
De todos los isótopos radiactivos del hafnio, que junto con los naturales suman un total de 34, el 178m2Hf es el más controversial debido a que en su decaimiento radiactivo libera radiación gamma, por lo que estos átomos podrían llegar a utilizarse como arma de guerra.
Usos/aplicaciones

Reacciones nucleares
El hafnio es un metal resistente a la humedad y a las altas temperaturas, además de que es un excelente absorbente de neutrones. Por esta razón, se utiliza en los reactores de agua a presión, así como en la fabricación de barras controladoras para los reactores nucleares, en cuyos recubrimientos están hechos de circonio ultrapuro, pues este sí debe ser capaz de transmitir los neutrones a través de él.
Aleaciones
Los átomos de hafnio pueden integrar otros cristales metálicos para dar lugar a diferentes aleaciones. Estas se caracterizan por ser tenaces y térmicamente resistentes, por lo que se destinan para aplicaciones espaciales, como en la construcción de las boquillas de motores para los cohetes.
Por otro lado, algunas aleaciones y compuestos sólidos de hafnio tienen propiedades especiales; tales como sus carburos y nitruros, HfC y HfN, respectivamente, los cuales son materiales muy refractarios. El carburo de tántalo y hafnio, Ta4HfC5, con un punto de fusión de 4215 ºC, es uno de los materiales más refractarios jamás conocidos.
Catálisis
Los metalocenos de hafnio se utilizan como catalizadores orgánicos para la síntesis de polímeros tales como el polietileno y el poliestireno.
Riesgos
Se desconoce hasta la fecha qué impacto podría tener en nuestro organismo los iones Hf4+. Por otro lado, debido a que se encuentran en la naturaleza en minerales de circonio, no se cree que lleguen a alterar el ecosistema de liberarse sus sales al medio ambiente.
Ahora bien, se recomienda manipular los compuestos de hafnio con cuidado, como si fueran tóxicos, aun cuando no haya estudios médicos que comprueben que sean nocivos para la salud.
El verdadero peligro del hafnio radica en las partículas de su sólido finamente molidas, las cuales pueden arder apenas al entrar en contacto con el oxígeno del aire.
Esto explica por qué cuando se le pule, acción que raspa su superficie y desprende partículas de metal puro, se liberan chispas ardientes con una temperatura de 2000 ºC; esto es, el hafnio presenta piroforicidad, única propiedad que conlleva riesgos de incendios o quemaduras graves.
