Agar Baird Parker: fundamento, preparación y uso
El agar Baird Parker es un medio de cultivo sólido, selectivo y diferencial. Fue creado en 1962 para la detección y recuento de estafilococos coagulasa positivos (Staphylococcus aureus).
Está compuesto por hidrolizado pancreático de caseína, extracto de carne, extracto de levadura, cloruro de litio, glicina, piruvato sódico, telurito potásico, agar y emulsión de yema de huevo.
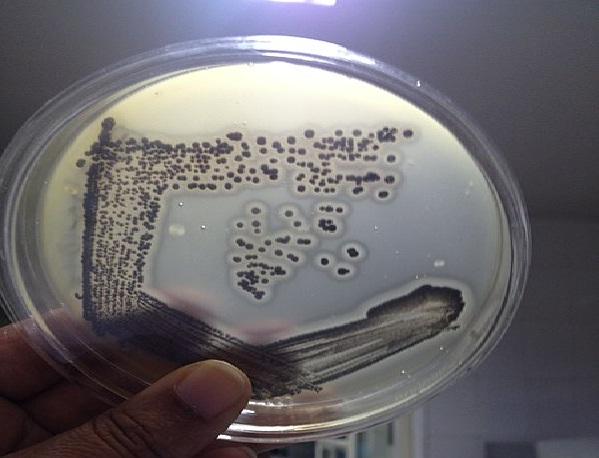
El agar Baird Parker se basa en la capacidad que tiene el S. aureus de reducir el telurito y producir lecitinasa. Ambas propiedades generan una colonia con características específicas para esta especie. Por tanto, brinda una gran efectividad en la detección de este microorganismo.
Las colonias típicas de S. aureus son negras o grises oscuras, con borde incoloro y un halo claro que las rodea, diferenciándose del resto de microorganismos. Este patógeno se puede encontrar en muestras clínicas, aguas, cosméticos y alimentos crudos o cocidos.
Su diagnóstico o detección es de suma importancia, debido a la variedad de patologías que produce, como intoxicación alimentaria, síndrome de la piel escaldada, síndrome del shock tóxico, abscesos, meningitis, septicemias, endocarditis, entre otras.
Índice del artículo
El hidrolizado pancreático de caseína, el extracto de carne y el extracto de levadura son las fuentes de nutrientes, vitaminas y minerales necesarios para el desarrollo general microbiano, mientras que el piruvato y la glicina son compuestos que favorecen el crecimiento específico de Staphylococcus aureus.
El agar Baird Parker es selectivo porque contiene sustancias que inhiben el crecimiento de la flora acompañante, mientras que favorece el desarrollo de S. aureus. Los compuestos inhibidores son el cloruro de litio y el telurito de potasio.
Este medio permite diferenciar el S. aureus del resto de los Estafilococos coagulasa negativos. S. aureus tiene la capacidad de reducir el telurito a teluro libre metálico negro, formando colonias negras o grises oscuras.
Así mismo, la yema de huevo proporciona los sustratos para evidenciar la presencia de la enzima lecitinasa y lipasa. S. aureus es lecitinasa positiva y por tanto se observará un halo claro alrededor de la colonia, indicando que la lecitina fue hidrolizada.
En este sentido, la aparición en este agar de colonias negras o grises oscuras brillantes con halo claro alrededor indican presencia de S. aureus.
Si se forma una zona de precipitación es indicativo de que hay actividad de la lipasa. Algunas cepas de S. aureus son lipasa positivas y otras negativas.
En el caso de que el S. aureus sea lipasa positiva se observará una zona opaca alrededor de la colonia negra o gris oscura, y luego el halo claro por la acción de la lecitinasa.
Las colonias de bacterias distintas a S. aureus capaces de crecer en este medio desarrollarán colonias incoloras o de color marrón, sin halo alrededor.
También se pueden observar colonias atípicas color negro con o sin borde incoloro, pero sin halo claro. Estas colonias no deben tomarse en cuenta, no corresponden a S. aureus.
Se toma un huevo fresco de gallina, se lava bien y se coloca 2 a 3 horas en alcohol al 70%. Luego, el huevo se abre asépticamente y se separa cuidadosamente la clara de la yema. Posteriormente se toman 50 ml de la yema y se mezclan con 50 ml de solución fisiológica estéril.
Algunas casas comerciales venden el telurito de potasio al 1% listo para usar. Se agrega al medio antes de que el medio solidifique.
Para preparar esta solución en el laboratorio se pesa 1.0 gr de telurito de potasio y se disuelve en una parte de agua. Posteriormente se completa la cantidad de agua hasta llegar a 100 ml. La solución debe esterilizarse por el método de filtración.
Pese 60 gr del medio deshidratado y disuelva en 940 ml de agua destilada. Deje la mezcla en reposo durante 5 a 10 minutos aproximadamente.
Aplique calor removiendo el medio frecuentemente para mejorar el proceso de disolución. Deje hervir por un minuto. Esterilice en el autoclave a 121°C por 15 minutos.
Deje reposar hasta que alcance una temperatura de 45°C y agregue 50 ml de la emulsión de yema de huevo y 10 ml de telurito al 1%. Mezcle bien y sirva entre 15 a 20 ml sobre placas de Petri estériles.
Dejar solidificar, ordenar de forma invertida en plaqueros y guardar en nevera hasta su uso.
El pH final del medio preparado debe quedar en 6,8 ± 0,2.
Antes de sembrar una muestra, se debe esperar a que la placa tome la temperatura del ambiente. Siembre las placas por estriamiento o por sembrado en superficie con espátula de Drigalski.
El color del medio deshidratado es tostado claro y el color del medio preparado es ámbar claro.
Las muestras clínicas se siembran de forma directa descargando parte del material en un extremo de la placa, y a partir de allí se estría por agotamiento. Incubar por 24 a 48 horas a 35-37°C.
Pesar 10 gr de la muestra de alimento y homogeneizar en 90 ml de agua peptonada al 0,1%, a partir de allí se preparan diluciones si es necesario. Inocular las placas por triplicado con 0,3 ml de las soluciones preparadas, y sembrar por superficie con espátula de Drigalski. Se incuba por 24 a 48 horas a 35-37°C.
Esta metodología permite realizar recuento de las colonias típicas obtenidas y es ideal cuando se sospecha la presencia de S. aureus por encima de 10 UFC por gr/ml de muestra.
Si se sospecha que la cantidad de S. aureus es pequeña o existe mucha flora acompañante, se sugiere enriquecer la muestra en caldo soya tripticasa con 10% de NaCl y 1% de piruvato de sodio. Esto favorecerá el crecimiento de S. aureus e inhibirá el desarrollo de la flora acompañante. Los tubos que resulten turbios se sembraran en agar Baird Parker.
En un sistema de filtración al vacío y esterilizado se filtran 100 ml de agua en estudio, y posteriormente la membrana microporosa de 0,4 micras se retira con una pinza estéril y se coloca sobre una placa de Baird Parker. Se incuba por 24 a 48 horas a 35-37°C. Esta técnica permite realizar el recuento de colonias típicas de S. aureus.
Para evaluar la calidad del agar Baird Parker se pueden utilizar cepas conocidas, como Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 o Proteus mirabilis ATCC 43071.
En el caso de las cepas de S. aureus ATCC se sabe que reduce el telurito, y son lipasa y lecitinasa positivas. Por tanto debe haber un desarrollo satisfactorio y crecer colonias convexas con centro negro y borde incoloro, con un halo opaco y otro halo más externo claro.
Por su parte, de S. epidermidis se espera un pobre desarrollo en este medio, con colonias gris amarronado a negras, sin halo claro.
Para E. coli y P. mirabilis se espera que sea inhibido total o parcialmente. En caso de crecer se desarrollarán colonias marrones sin zona opaca, ni halo claro.
-No se debe calentar el medio después de agregar el telurito y la yema de huevo.
-La preparación de la emulsión de yema de huevo y su agregado en el medio es un paso muy vulnerable de contaminación. Se deben extremar los cuidados.
-Si hay presencia de colonias típicas de S. aureus se debe corroborar montando una prueba de coagulasa a dicha cepa.
-Si existen resultados dudosos con la coagulasa, se deben montar otras pruebas confirmatorias.
-Tener cuidado de no confundir la presencia de colonias típicas de S. aureus con las colonias atípicas de color negro.
- Wikipedia contributors. Baird-Parker agar. Wikipedia, The Free Encyclopedia. March 15, 2017, 19:36 UTC. Available at: wikipedia.org/ Accessed February 18, 2019.
- BD Laboratorios. Baird Parker Agar. 2006. Disponible en: bd.com
- Laboratorios Britania. Baird Parker agar base. 2015. Disponible en: britanialab.com
- Laboratorios Francisco Soria Melguizo. 2009. Baird Parker Agar. Disponible en: http://f-soria.es/Inform
- Laboratorios Britania. Telurito de potasio. 2015. Disponible en: britanialab.com
- Alarcón-Lavín M, Oyarzo C, Escudero C, Cerda-Leal F, Valenzuela F. Portación de Staphylococcus aureus enterotoxigénico tipo A, en frotis nasofaríngeos en manipuladores de alimentos. Rev Med Chile 2017; 145: 1559-1564
- Norma Venezolana Covenin 1292-89. (1989). Alimentos. Aislamiento y recuento de Staphylococcus aureus. Disponible en: sencamer.gob.ve
