Cinética enzimática: qué es, conceptos, ecuaciones
¿Qué es la cinética enzimática?
La cinética enzimática es un campo de estudio en el que la fisicoquímica y la bioquímica se juntan para estudiar las reacciones químicas catalizadas por las enzimas. Las enzimas son catalizadores biológicos que incrementan la velocidad de una reacción química mediante la disminución de su energía de activación.
Las enzimas catalizan reacciones químicas de gran importancia para el mantenimiento de la vida. Tienen tanto un pH como una temperatura óptimos para ejercer su acción catalítica sobre el sustrato, por lo que son factores esenciales en el estudio de sus actividades.
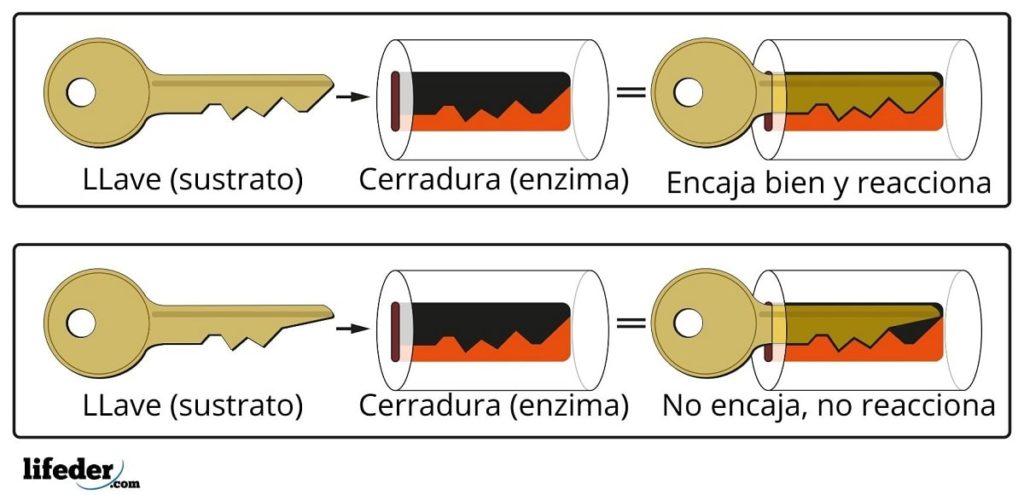
La enzima interacciona con el sustrato a través de una región especializada de su cadena proteica, la cual recibe el nombre de centro activo, cuya estructura tridimensional se acopla a la estructura del sustrato. La interacción entre el centro activo y el sustrato suele ser débil y no covalente.
El número de centros activos de las enzimas es limitado, produciendo su saturación con las moléculas de sustrato, lo que a su vez impide que la velocidad de la reacción pueda aumentar más allá de un valor determinado, conocido como velocidad máxima.
La cinética enzimática no solo combina bioquímica y fisicoquímica, sino también bioinorgánica, química supramolecular, química computacional, y estadísticas.
Entre los modelos que la describen se encuentra el de Michaelis-Menten, que explica cómo varía la velocidad de una reacción enzimática con un sustrato simple en función de la concentración del sustrato. Hoy en día sigue siendo uno de los modelos que más se utiliza para describir la cinética enzimática.
Conceptos básicos en cinética enzimática
Catálisis enzimática
Las enzimas son proteínas, con actividades catalíticas, capaces de actuar sobre una molécula denominada sustrato, catalizando su transformación en otra sustancia conocida como producto. Las enzimas no son consumidas durante su acción catalítica, permaneciendo su masa constante.
Actividad catalítica
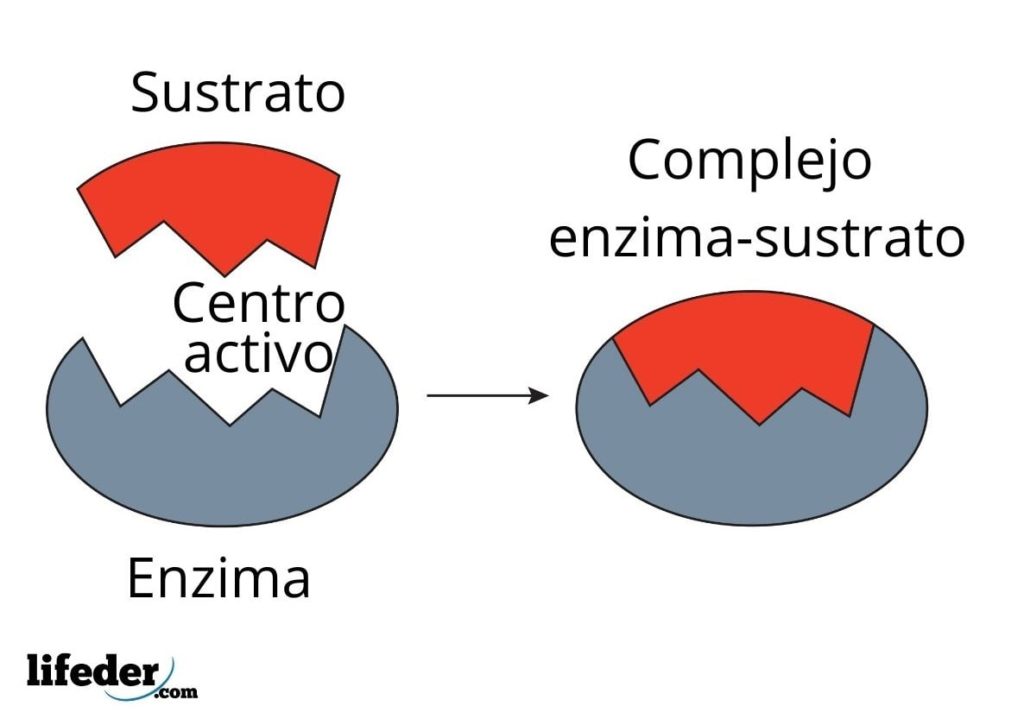
La actividad catalítica de la enzima es realizada en una estructura tridimensional especializada conocida como el centro activo. Este está formado por el pliegue de la cadena proteica enzimática que determina la interacción de un grupo de aminoácidos que forman el centro activo.
Centro activo
El centro activo no es una estructura rígida, sino que capaz de amoldarse geométricamente al sustrato para interaccionar con él. La interacción es generalmente débil (fuerzas de Van der Waals), aunque hay enzimas que forman un enlace covalente con el sustrato.
Disminución de la energía de activación
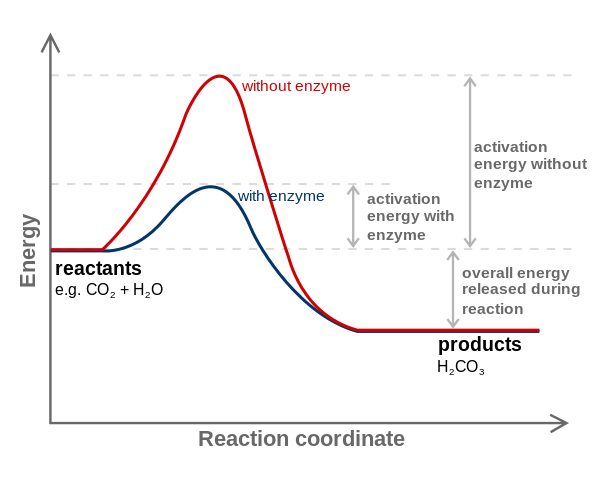
Las enzimas catalizan las reacciones disminuyendo la energía de activación, y por lo tanto, disminuyendo asimismo el consumo de energía libre (G) necesario para la realización del proceso catalizado. Las enzimas no modifican el punto de equilibrio de las reacciones químicas no catalizadas.
Nótese cómo la enzima anhidrasa carbónica disminuye la energía de activación para la conversión del CO2 a H2CO3. Aunque la distancia entre la línea roja y la azulada no parezca gran cosa, esta enzima incrementa la velocidad en el orden de millones de veces (106), en comparación a la reacción llevada a cabo sin su participación.
Estereoespecificidad
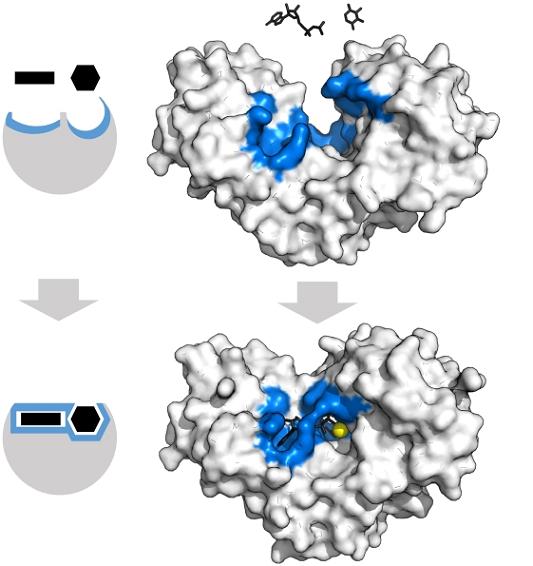
Las enzimas, en general, son altamente específicas para las reacciones que catalizan, ya que las moléculas del sustrato deben interaccionar con el centro activo que presenta un conjunto de requerimientos para su acoplamiento con él.
Así por ejemplo, el centro activo de la hexoquinasa, el cual es dinámico por las vibraciones moleculares de las cadenas proteicas, ofrece los grupos en las orientaciones espaciales exactas para que las moléculas de adenosín trifosfato, y xilosa, calcen como si fueran piezas rellenando huecos geométricos.
La más leve perturbación física o química, y la región azulada de la hexoquinasa ya no podrá alojar a los sustratos.
Velocidad máxima
Las enzimas poseen un número limitado de centros activos, por lo que al aumentar la concentración de sustrato se saturarán. Esto determina que la velocidad de la reacción catalizada enzimáticamente no puede aumentar más allá de un cierto valor, conocida como velocidad máxima.
Sensibilidad a la temperatura y pH
La actividad catalítica enzimática es dependiente de la temperatura y el pH, teniendo valores óptimos de estos parámetros para su funcionamiento. Asimismo, por ser las enzimas moléculas proteicas, son susceptibles a una desnaturalización química o térmica.
Cofactores
Algunas enzimas incrementan su actividad catalítica por la influencia de ciertos factores, que pueden ser metales o compuestos orgánicos conocidos como coenzimas.
Asimismo, las enzimas pueden ser inhibidas en forma competitiva y en forma no competitiva. En el caso de la hexoquinasa de arriba, el Mg2+ (esfera amarilla) actúa como cofactor.
Velocidad de reacción enzimática
La velocidad de una reacción enzimática depende de la concentración del sustrato y de la concentración enzimática. Cuando la concentración de sustrato es baja, existe una relación casi lineal entre la velocidad enzimática y la concentración del sustrato.
Por lo tanto, la velocidad enzimática aumenta en proporción directa a la concentración del sustrato; pero al aumentar la concentración de sustrato a un valor que satura los sitios activos de la enzima, se alcanza la velocidad máxima.
Una vez que esto ocurre la velocidad enzimática se hace constante, es decir, es independiente de la concentración del sustrato y se dice que la velocidad enzimática es de orden cero. Además, la velocidad enzimática catalítica es proporcional a la concentración del complejo enzima-sustrato [ES].
Tal como lo muestra la expresión matemática:
V = k2[ES]
La velocidad máxima es directamente proporcional a la concentración total de la enzima, como aparece en la fórmula siguiente:
Vmax = KcatEt
Kcat es el número de rotación o recambio y representa el número de moléculas de sustrato que cada sitio enzimático convierte en producto por unidad de tiempo. Mientras, Et representa el número de sitios enzimáticos catalíticos. Si Et tiene un valor alto, se requiere de una mayor [S] para saturar los sitios o centros activos.
Ecuación de Michaelis-Menten
Modelo
El modelo de Mihaelis-Menten está basado en la acción de enzimas que actúan sobre un sustrato simple y no es aplicable a las enzimas alostéricas; es decir, aquellas que tienen una región reguladora de la actividad catalítica del sitio activo.
Las enzimas a una baja concentración de sustrato, presentan una actividad catalítica que es lineal con la concentración de sustrato; pero a altas concentraciones de sustrato, la actividad catalítica es independiente de la concentración de sustrato.
En 1913, Leonor Michelis y Maud Menten propusieron un modelo para explicar el comportamiento enzimático señalado, siendo de importancia en el modelo la existencia de un complejo intermediario de enzima-sustrato [ES].
Ecuación general
La relación de este complejo con los otros componentes del proceso enzimáticos, así como con las constantes (K) que los relacionan, aparecen señaladas en el esquema siguiente:
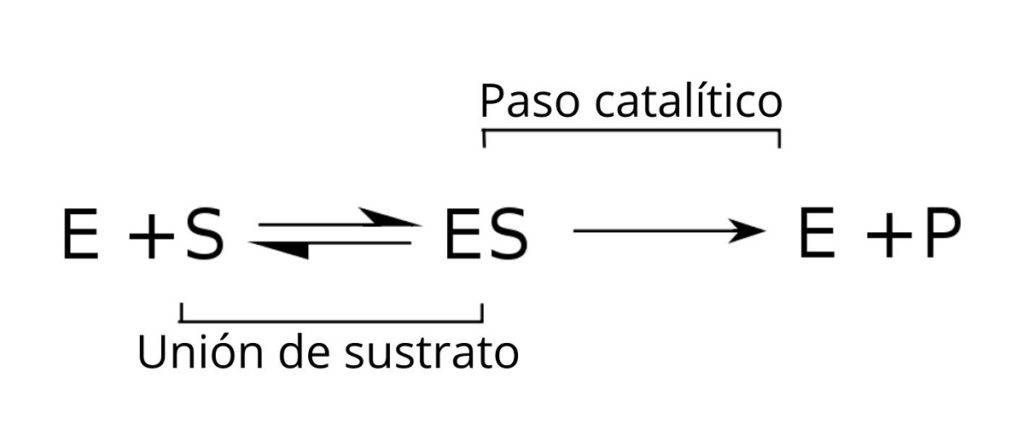
La enzima (E) se combina con el sustrato (S) para formar el complejo enzima-sustrato con una constante de velocidad K1. El complejo E-S puede disociarse en E y S con una constante de velocidad de reacción K-1.
Asimismo, el complejo ES puede originar un producto (P) y la separación de la enzima, la cual puede ser reciclada para cumplir otro ciclo de actividad enzimática. Se puede alcanzar una situación de equilibrio para el estado [ES] en el cual su velocidad de formación es igual a su velocidad de descomposición.
K1[ES][S] = (K-1 + K2)[ES] (1)
Reagrupando términos y despejando [ES], se tiene:
[ES] = ([E][S]) / (K-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM es una constante introducida por Michaelis.
Términos de la ecuación de Michaelis-Menten
Sustituyendo ahora KM en (2) continuamos:
[ES] = [E][S] / KM (3)
La concentración de enzima no combinada es:
[E] = [ET] – [ES] (4)
Donde [E] es la enzima libre y [ET] la concentración total de la enzima.
Combinando las ecuaciones 3 y 4, haciendo las sustituciones debidas, y teniendo en cuenta además Vmax, se llega a la ecuación de Michaelis-Menten, expresada en la forma siguiente:
V = (Vmax [S]) / ([S] + KM)
La máxima velocidad de la reacción enzimática ocurre cuando la concentración de sustrato es mucho mayor que KM y los sitios catalíticos de las enzimas se encuentran saturados con sustrato. Esto ocurre cuando la relación [S]/[S] + KM se aproxima a 1.
Cuando [S] es igual a KM, la porción de la ecuación [S] / [S] + KM es igual a 1/2, indicando que KM es la concentración de sustrato que produce una velocidad de reacción enzimática que es la mitad de la velocidad máxima.
Además, KM es una medida de la afinidad de una enzima por el sustrato: mientras mayor sea el valor del KM, menor será la afinidad de la enzima por el sustrato y viceversa. Por lo tanto, a un KM alto la velocidad de la reacción enzimática será baja.
Gráfico de Lineweaver-Burk
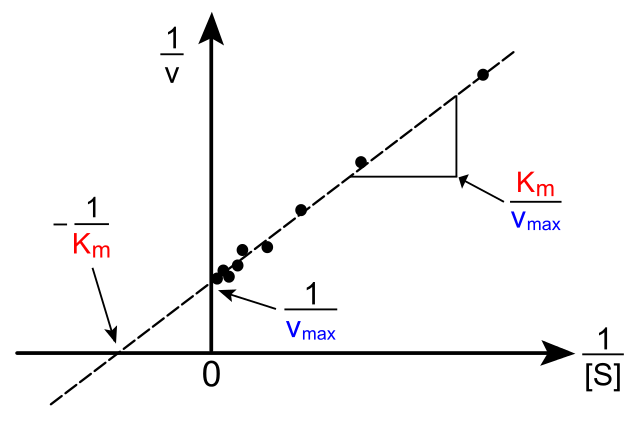
La transformación de la ecuación de Michaelis-Menten, para producir su forma inversa tiene la forma siguiente:
1/V = (KM / Vmax) (1/[S]) + 1 / Vmax
La importancia de esta recta es que tiene una intersección con el eje X en – 1/KM, y con el eje Y en Y = 1/Vmax (imagen superior). La recta tiene una pendiente de KM/Vmax. Esto permite obtener una información acerca de Vmax y de KM graficando el inverso de las velocidades en función del inverso de las concentraciones de sustrato.
Referencias
- Strayer, L. (1975). Bioquímica. 2da Edición. Editorial Reverté.
- Ira N. Levine. (2009). Principios de fisicoquímica. Sexta edición. Mc Graw Hill.
- Wikipedia. (2020). Enzyme Kinetics. Recuperado de: en.wikipedia.org
- Michael Blaber. (05 de junio de 2019). Enzyme Kinetics. Biology LibreTexts. Recuperado de: bio.libretexts.org
- The Editors of Encyclopaedia Britannica. (2020). Michaelis-Menten kinetics. Recuperado de: britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochemistry. 5th edition. New York: W H Freeman; (2002). Section 8.4: The Michaelis-Menten Model Accounts for the Kinetic Properties of Many Enzymes. Recuperado de: ncbi.nlm.nih.gov
