Modelo mecánico cuántico del átomo: qué es y principios
¿Qué es el modelo mecánico cuántico del átomo?
El modelo mecánico cuántico del átomo supone que este está formado por un núcleo central conformado por protones y neutrones. Los electrones, de carga negativa, envuelven el núcleo en regiones difusas conocidas como orbitales.
La forma y extensión de los orbitales electrónicos queda determinada por varias magnitudes: el potencial del núcleo y los niveles cuantizados de energía y de momentum angular de los electrones.

De acuerdo a la mecánica cuántica los electrones tienen comportamiento dual de onda-partícula y a escala atómica son difusos y no puntuales. Las dimensiones del átomo quedan prácticamente determinadas por la extensión de los orbitales electrónicos que rodean al núcleo positivo.
En la figura 1 se muestra la estructura del átomo de helio, que tiene un núcleo con dos protones y dos neutrones. Dicho núcleo está rodeado por la nube de probabilidad de los dos electrones que envuelven al núcleo, el cual es cien mil veces más pequeño. En la siguiente imagen se puede observar el átomo de helio, con los protones y neutrones en el núcleo y los electrones en orbitales.
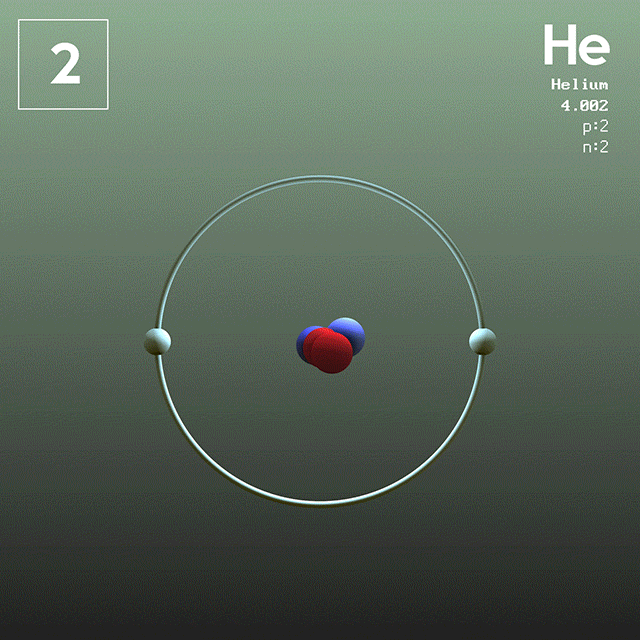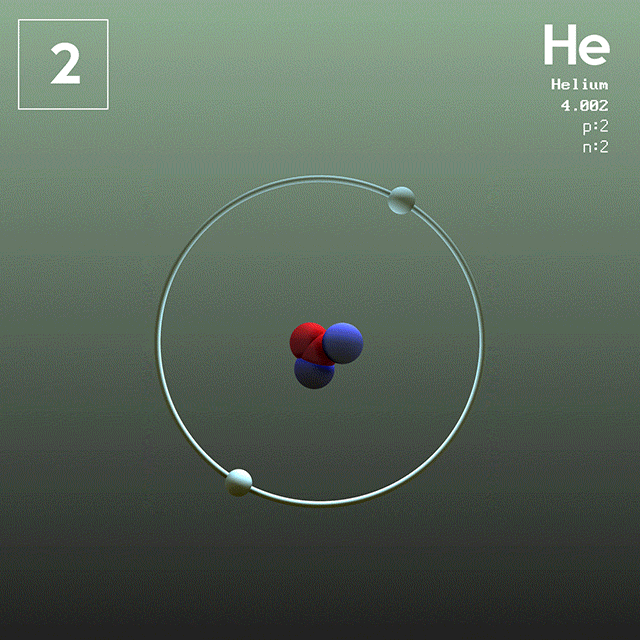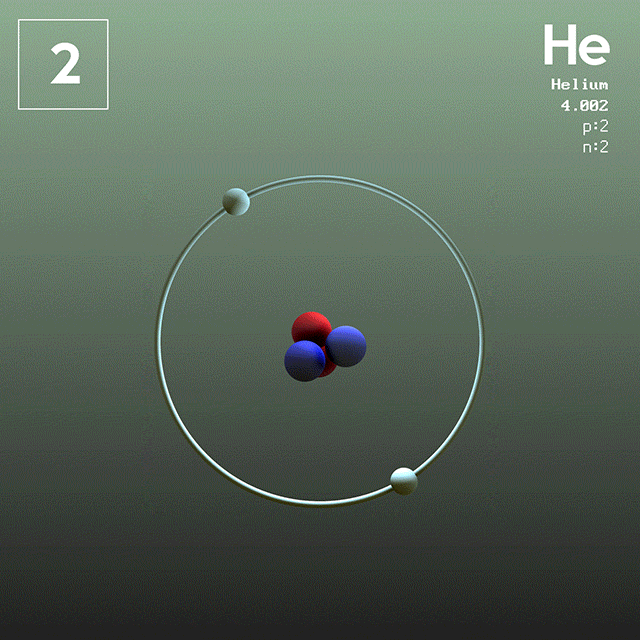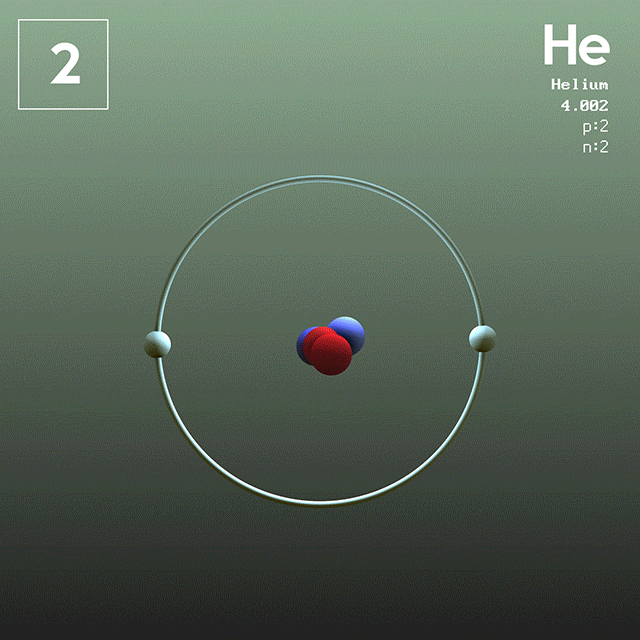
El tamaño de un átomo de helio es del orden de un angstrom (1 Å), es decir 1 x 10^-10 m. Mientras que el tamaño de su núcleo es del orden de un femtómetro (1 fm), es decir 1 x 10^-15 m.
Pese a ser tan pequeño comparativamente, el 99,9% del peso atómico está concentrado en el diminuto núcleo. Esto es debido a que los protones y neutrones son 2 mil veces más pesados que los electrones que los rodean.
Escala atómica y comportamiento cuántico
Uno de los conceptos que más influencia tuvo en el desarrollo del modelo atómico fue el de la dualidad onda – partícula: el descubrimiento de que cada objeto material tiene asociada una onda de materia.
La fórmula que permite calcular la longitud de onda λ asociada a un objeto material fue propuesta por Louis De Broglie en 1924 y es la siguiente:
λ = h / (m v)
Donde h es la constante de Planck, m la masa y v la velocidad.
Según el principio de De Broglie, todo objeto tiene un comportamiento dual, pero dependiendo de la escala de las interacciones, de la velocidad y de la masa, puede ser más preeminente el comportamiento ondulatorio que el de partícula o viceversa.
El electrón es ligero, su masa es 9,1×10^-31 kg. La velocidad típica de un electrón es de 6000 km/s (cincuenta veces menor que la velocidad de la luz). Esta velocidad se corresponde con valores de energía en el rango de las decenas de electrón-voltio.
Con los datos anteriores, y mediante el uso de la fórmula de De Broglie, puede obtenerse la longitud de onda para el electrón:
λ = 6,6 x 10^-34 J s / (9,1×10^-31 kg 6 x 10^6 m/s) = 1 x 10^-10 m = 1 Å
El electrón a las energías típicas de los niveles atómicos, tiene una longitud de onda del mismo orden de magnitud que el de la escala atómica, por lo que a esa escala tiene un comportamiento ondulatorio y no de partícula.
Primeros modelos cuánticos
Con la idea en mente de que el electrón a escala atómica tiene comportamiento ondulatorio, se elaboraron los primeros modelos atómicos fundamentados en los principios cuánticos. Entre estos destaca el modelo atómico de Bohr, que predecía a la perfección el espectro de emisión del hidrógeno, pero no el de otros átomos.
El modelo de Bohr y posteriormente el de Sommerfeld, eran modelos semi-clásicos. Es decir, el electrón se trataba como una partícula sometida a la fuerza de atracción electrostática del núcleo que orbitaba a su alrededor, regida por la segunda ley de Newton.
Adicionalmente a las órbitas clásicas, estos primeros modelos tomaban en cuenta que el electrón tenía una onda material asociada. Únicamente las órbitas cuyo perímetro era un número entero de longitudes de onda eran las permitidas, ya que las que no cumplen este criterio se desvanecen por la interferencia destructiva.
Es entonces que aparece por primera vez la cuantización de la energía en la estructura atómica.
La palabra cuántica precisamente viene del hecho que el electrón solo puede tomar algunos valores discretos de energía dentro del átomo. Esto coincide con el hallazgo de Planck, que consistió en el descubrimiento que una radiación de frecuencia f interactúa con la materia en paquetes de energía E = h f, donde h es la constante de Planck.
Forma y tamaño de los orbitales
El alcance radial del orbital queda determinado por la función de onda radial. Es mayor en la medida que crece la energía del electrón, es decir en la medida que el número cuántico principal aumenta.
La distancia radial suele medirse en radios de Bohr, que para la energía más baja del hidrógeno es 5,3 X 10-11 m = 0,53 Å.

Pero la forma de los orbitales queda determinada por el valor del número cuántico de momento angular. Si l=0 se tiene un orbital de forma esférica llamado s, si l=1 se tiene un orbital lobulado llamado p, el cual puede tener tres orientaciones de acuerdo al número cuántico magnético. La siguiente figura muestra la forma de los orbitales.
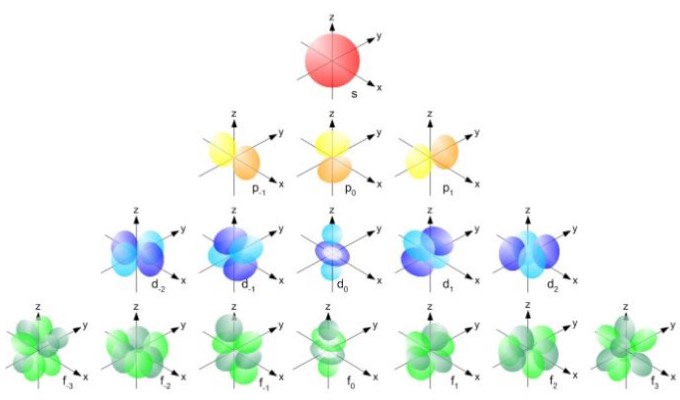
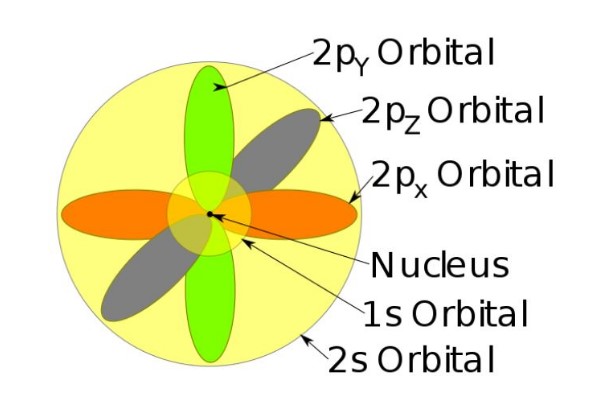
Estos orbitales se empaquetan unos dentro de otros según la energía de los electrones. Por ejemplo, la siguiente figura muestra los orbitales en un átomo de sodio.
El espín
El modelo mecánico cuántico de la ecuación de Schrödinger no incorpora el espín del electrón. Pero se toma en cuenta a través del principio de exclusión de Pauli, el cual indica que los orbitales pueden poblarse hasta con dos electrones con números cuánticos de espín s= +½ y s= -½.
Por ejemplo, el ión de sodio tiene 10 electrones, es decir, si nos remitimos a la figura anterior, hay dos electrones por cada orbital.
Pero si se trata del átomo neutro de sodio, hay 11 electrones, el último de los cuales ocuparía un orbital 3s (no mostrado en la figura y de mayor radio que el 2s). El espín del átomo es determinante en las características magnéticas de una sustancia.
Referencias
- Alonso – Finn. Fundamentos cuánticos y estadísticos. Addison Wesley.
- Eisberg – Resnick. Física cuántica. Limusa – Wiley.
- Gasiorowicz. Quantum physics. John Wiley & Sons.
- HSC. Physics course 2. Jacaranda plus.
- Wikipedia. Modelo atómico de Schrodinger. Recuperado de: Wikipedia.com
