Óxido de cinc (ZnO): estructura, propiedades, usos, riesgos
El óxido de cinc es un compuesto inorgánico cuya fórmula química es ZnO. Se compone únicamente de iones Zn2+ y O2- en una relación 1:1; sin embargo, su red cristalina puede presentar vacancia de O2-, lo cual da a lugar defectos estructurales capaces de alterar los colores de sus cristales sintéticos.
Comercialmente se adquiere como un sólido blanco polvoriento (imagen inferior), el cual se produce directamente de la oxidación del cinc metálico por el Proceso Francés; o sometiendo a reducción carbotérmica a las menas de cinc, de tal modo que sus vapores se oxidan luego y terminan solidificando.
Otros métodos de preparación del ZnO consisten en hacer precipitar su hidróxido, Zn(OH)2, a partir de las disoluciones acuosas de sales de cinc. Asimismo, finas películas o nanopartículas morfológicamente variadas de ZnO pueden sintetizarse mediante técnicas más sofisticadas como la deposición química de sus vapores.
Este óxido metálico se encuentra en la naturaleza como mineral cincita, cuyos cristales suelen ser amarillos o anaranjados debido a las impurezas metálicas. Los cristales de ZnO se caracterizan por ser piezoeléctricos, termocromáticos, luminiscentes, polares, y por tener además una banda energética muy ancha en sus propiedades semiconductoras.
Estructuralmente es isomórfico al sulfuro de cinc, ZnS, adoptando cristales hexagonales y cúbicos semejantes a los de la wurzita y blenda, respectivamente. En estos existe cierto carácter covalente en las interacciones entre el Zn2+ y O2-, lo cual hace que haya una distribución heterogénea de las cargas en el cristal de ZnO.
Los estudios de las propiedades y usos del ZnO se extienden a los campos de la física, electrónica y biomedicina. Sus usos más simples y cotidianos pasan inadvertidos en la composición de cremas faciales y productos de higiene personal, así como en los protectores solares.
Índice del artículo
El ZnO cristaliza en condiciones normales de presión y temperatura en una estructura hexagonal wurzita. En esta estructura los iones Zn2+ y O2- se disponen en capas alternadas, de tal modo que cada uno termina rodeado de un tetraedro, habiendo ZnO4 o OZn4, respectivamente.
Asimismo, utilizando una “plantilla” o soporte cúbico, puede hacerse cristalizar el ZnO en una estructura cúbica de cinc blenda; la cual, al igual que la wurzita, corresponden a estructuras isomórficas (idénticas en el espacio pero con iones diferentes) del sulfuro de cinc, ZnS.
Además de estas dos estructuras (wurzita y blenda), el ZnO bajo altas presiones (alrededor de los 10 GPa) cristaliza en la estructura sal gema, la misma que la del NaCl.
Las interacciones entre el Zn2+ y O2- presentan cierto carácter de covalencia, por lo que existe parcialmente un enlace covalente Zn-O (ambos átomos con hibridación sp3), y debido a la distorsión de los tetraedros, estos manifiestan un momento dipolar que se suma a las atracciones iónicas de los cristales de ZnO.
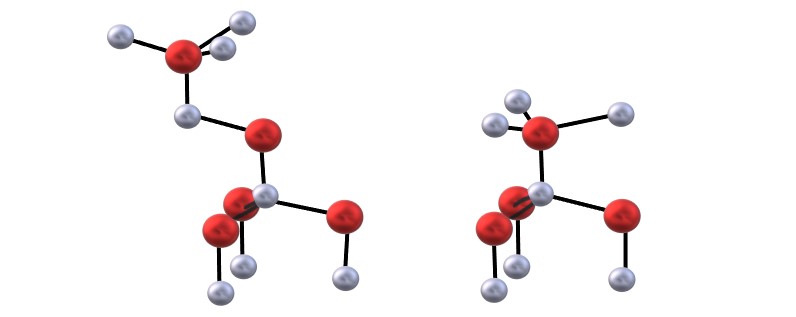
Se tiene la imagen superior para visualizar los tetraedros mencionados para las estructuras del ZnO.
La diferencia entre las estructuras blenda y wurzita radica también en que vistas desde arriba, los iones no se encuentran eclipsados. Por ejemplo, en la wurzita, se aprecia que las esferas blancas (Zn2+) están justo encima de las esferas rojas (O2-). En cambio, en la estructura cúbica de blenda no ocurre así porque hay tres capas: A, B y C en lugar de solo dos.
Los cristales de ZnO si bien tienden a tener estructuras hexagonales de wurzita, en lo que respecta a la morfología de sus nanopartículas es otra historia. Dependiendo de los parámetros y métodos de síntesis, estas pueden adoptar formas tan variadas como varillas, platos, hojas, esferas, flores, cinturones, agujas, entre otras.
Sólido polvoriento de color blanco, inodoro y de sabor amargo. En la naturaleza puede encontrarse cristalizado, con impurezas metálicas, como mineral cincita. Si tales cristales son blancos presentan termocromismo, lo cual significa que al calentárseles cambian de coloración: de blanco a amarillo.
Asimismo, sus cristales sintéticos pueden presentar coloraciones rojizas o verdosas en función de su composición estequiométrica de oxígeno; es decir, los huecos o vacancias ocasionadas por la falta de aniones O2- afecta directamente el modo en cómo la luz interacciona con las redes iónicas.
81,406 g/mol
1974 ºC. A esta temperatura sufre descomposición térmica liberando vapores de cinc y oxígeno molecular o gaseoso.
5,1 g/cm3
El ZnO es prácticamente insoluble en el agua, apenas dando lugar a disoluciones con una concentración de 0,0004% a 18 ºC.
El ZnO puede reaccionar tanto con ácidos como con bases. Cuando reacciona con un ácido en disolución acuosa, aumenta su solubilidad al formarse una sal soluble donde el Zn2+ termina acomplejándose con las moléculas de agua: [Zn(OH2)6]2+. Por ejemplo, reacciona con el ácido sulfúrico para producir sulfato de cinc:
ZnO + H2SO4 → ZnSO4 + H2O
Similarmente reacciona con los ácidos grasos para formas sus respectivas sales, como estearato y palmitato de cinc.
Y cuando reacciona con una base, en presencia de agua, se forman las sales de cincato:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
40,3 J/K·mol
3,3 eV. Este valor lo vuelve un semiconductor de banda ancha, capaz de operar bajo intensos campos eléctricos. Presenta además características de ser un semiconductor de tipo n, lo cual no ha podido explicarse las razones de que haya en su estructura un aporte extra de electrones.
Este óxido se distingue por sus propiedades ópticas, acústicas y electrónicas, gracias a las cuales se le considera un candidato para potenciales aplicaciones relacionadas al desarrollo de dispositivos optoelectrónicos (sensores, diodos láseres, celdas fotovoltaicas). El porqué de tales propiedades escapa al terreno de la física.
El óxido de cinc se ha utilizado como aditivo en numerosas cremas blancas para el tratamiento de irritaciones, acnés, dermatitis, abrasiones y grietas en la piel. En este ámbito, es popular su uso para aliviar las irritaciones que ocasionan los pañales en las pieles de los bebés.
Asimismo, es un componente de los protectores solares, pues junto con las nanopartículas de dióxido de titanio, TiO2, ayuda a bloquear las radiaciones ultravioletas del Sol. Igualmente, actúa como un agente espesante, por lo que se halla en ciertos maquillajes claros, lociones, esmaltes, talcos y jabones.
Por otro lado, el ZnO es una fuente de cinc utilizada en los suplementos dietéticos y productos vitamínicos, así como en cereales.
De acuerdo a la morfología de sus nanopartículas, el ZnO puede activarse bajo radiación ultravioleta para generar peróxidos de hidrógeno o especies reactivas que debiliten las membranas celulares de los microorganismos.
Al suceder esto, las restantes nanopartículas de ZnO surcan el citoplasma y comienzan a interaccionar con el compendio de biomoléculas que conforman la célula, trayendo como consecuencia su apoptosis.
Es por eso que no todas las nanopartículas pueden utilizarse en las composiciones de los protectores solares, sino únicamente aquellas que carecen de actividad antibacterial.
Los productos con este tipo de ZnO se destinan, recubiertos de materiales poliméricos solubles, para tratar infecciones, heridas, úlceras, bacterias e inclusive diabetes.
El pigmento conocido como cinc blanco se trata del ZnO, el cual se adiciona a varias pinturas y recubrimientos para proteger de la corrosión a las superficies metálicas donde se les apliquen. Por ejemplo, los recubrimientos con ZnO adicionado se utilizan para proteger al hierro galvanizado.
Por otro lado, estos recubrimientos también se han utilizado sobre el vidrio de las ventanas para impedir que el calor penetre (si se halla en el exterior) o ingrese (si está en el interior). Asimismo, protege algunos materiales poliméricos y textiles de su deterioro por acción de la radiación solar y del calor.
La luminiscencia de las nanopartículas de ZnO se ha estudiado para ser empleada en la realización de bioimágenes, estudiando así mediante las luces azules, verdes o anaranjadas que irradian, las estructuras internas de las células.
El ZnO también encuentra uso como aditivo en los cauchos, cementos, materiales dentífricos, vidrios y cerámicas, debido a su menor punto de fusión y, por tanto, comportándose como un agente fundente.
El ZnO elimina los gases desagradables de H2S, ayudando a desulfurar algunas emanaciones de gases:
ZnO + H2S → ZnS + H2O
El óxido de cinc como tal es un compuesto no tóxico e inofensivo, por lo que la manipulación prudente de su sólido no representa ningún riesgo.
El problema sin embargo radica en su humo, pues si bien a altas temperaturas se descompone, los vapores de cinc terminan contaminando los pulmones y ocasionando una especie de “fiebre metálica”. Esta enfermedad se caracteriza por los síntomas de tos, fiebre, sensación de opresión en el pecho, y un sabor metálico constante en la boca.
Tampoco es cancerígeno, y las cremas que lo contienen no han demostrado que aumentan la absorción de cinc en la piel, por lo que los protectores solares a base de ZnO se consideran seguros; a menos que haya reacciones alérgicas, que en dicho caso debe detenerse su uso.
Respecto a ciertas nanopartículas destinadas para combatir bacterias, estas pudieran ejercer efectos negativos si no son transportadas correctamente hacia su sitio de acción.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Zinc oxide. Recuperado de: en.wikipedia.org
- Hadis Morkoç and Ümit Özgur. (2009). Zinc Oxide: Fundamentals, Materials and Device Technology. [PDF]. Recuperado de: application.wiley-vch.de
- Parihar, M. Raja and R. Paulose. (2018). A brief review of structural, electrical and electrochemical properties of zinc oxide nanoparticles. [PDF]. Recuperado de: ipme.ru
- A. Rodnyi and I. V. Khodyuk. (2011). Optical and Luminescence Properties of Zinc Oxide. Recuperado de: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin, & Husen, A. (2018). Properties of Zinc Oxide Nanoparticles and Their Activity Against Microbes. Nanoscale research letters, 13(1), 141. doi:10.1186/s11671-018-2532-3
- ChemicalSafetyFacts. (2019). Zinc Oxide. Recuperado de: chemicalsafetyfacts.org
- Jinhuan Jiang, Jiang Pi, and Jiye Cai. (2018). The Advancing of Zinc Oxide Nanoparticles for Biomedical Applications. Bioinorganic Chemistry and Applications, vol. 2018, Article ID 1062562, 18 pages. doi.org/10.1155/2018/1062562
