¿Qué es la energía de ionización?
¿Qué es la energía de ionización?
La energía de ionización, representada por el símbolo I, es la cantidad de energía mínima requerida para arrancarle el electrón más externo a un mol de átomos en estado gaseoso, en su estado fundamental. En otras palabras, es la cantidad mínima de energía requerida para transformar un mol de átomos neutros en estado gaseoso en un mol de iones con una carga positiva (de allí su nombre).
Visto en forma de una ecuación química, la energía de ionización vendría a ser la energía requerida para el siguiente proceso:
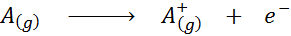
La energía de ionización es una medida directa de qué tan fuertemente están enlazados los electrones de valencia más externos a un átomo de un elemento químico. Al definirse como la energía del proceso de ionización en estado gaseoso, se evita la contribución o interferencia de las interacciones intermoleculares que ocurren en los estados líquido y sólido.
De esta forma, se asegura que la energía de ionización solo dependa de las fuerzas internas del átomo y, en particular, de la estabilidad de los electrones que forman la capa de valencia de cada elemento.
El proceso de remover un electrón de la capa de valencia es un proceso que requiere energía, por lo que es un proceso endotérmico. Por esta razón, las energías de ionización siempre son positivas (por convención, cuando la energía entra a un sistema se considera positiva).
Existe más de una energía de ionización
A pesar de que la definición de la energía de ionización se aplica a átomos neutros que se convierten en iones positivos (es decir, cationes), también se puede aplicar a la remoción sucesiva de los electrones de iones positivos, es decir, especies que ya han perdido electrones.
En este sentido, la energía para ionizar al átomo neutro viene a ser tan solo la primera de muchas energías de ionización posibles, ya que existe una para cada electrón que gira en torno al núcleo.
En otras palabras, las energías asociadas a todos los siguientes procesos se consideran energías de ionización:
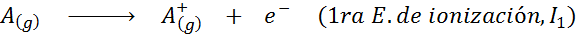
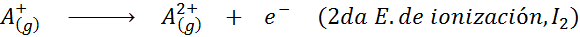
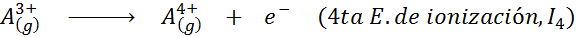
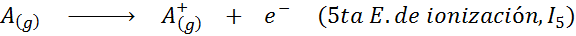
Orden de las energías de ionización sucesivas
Para cualquier átomo de cualquier elemento, se cumple que una energía de ionización siempre será mayor que todas las energías de ionización anteriores. Es decir que las energías de ionización sucesivas tienen la siguiente relación:
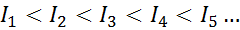
La razón por la que esto ocurre es muy sencilla. La primera energía de ionización involucra removerle un electrón a un átomo neutro. Sin embargo, la segunda energía de ionización implica quitarle un electrón a un átomo que ya perdió el primero.
La ausencia de un electrón deja una carga neta positiva que atrae con más fuerzas a los electrones restantes, por lo que son más difíciles de arrancar. Además, esta ausencia también reduce el efecto de apantallamiento que los electrones tienen sobre los electrones más externos, por lo que el núcleo es capaz de atraerlos más fuertemente.
El resultado es que resulta más difícil arrancar el segundo electrón que el primero, y será más difícil arrancar el tercero que el segundo, y así sucesivamente, como se puede ver en la siguiente tabla de energías de ionización para los primeros 10 elementos de la tabla periódica.
Z | Elemento | Primera | Segunda | Tercera | Cuarta | Quinta | Sexta |
1 | H | 1312 | |||||
2 | He | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Be | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | O | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Tendencia periódica de la energía de ionización
La energía de ionización es una propiedad periódica que aumenta de izquierda a derecha y de abajo a arriba en la tabla periódica, como se puede observar en la siguiente gráfica.
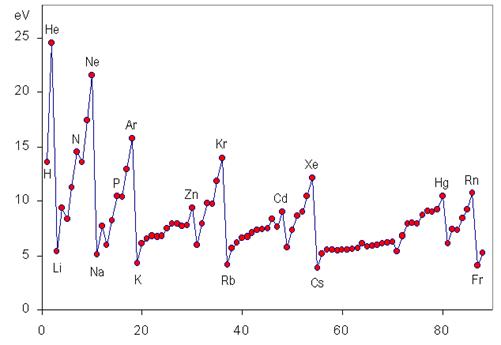
Variación de I a lo largo de un período
Al movernos a lo largo de un período de izquierda a derecha, va aumentando progresivamente algo llamado la carga nuclear efectiva, que no es más que la carga positiva real que los electrones más externos pueden “ver” debido al apantallamiento de los electrones más internos.
Esto significa que va aumentando la fuerza con la que el núcleo es capaz de atraer a los electrones de valencia, por lo que se hace más difícil arrancarlos y la energía requerida (es decir, la energía de ionización) se hace mayor.
Variación de I a lo largo de un grupo
Al descender en un grupo, estamos colocando electrones en niveles de energía cada vez mayores y, por lo tanto, en orbitales atómicos cada vez más alejados del núcleo. Por esta razón, la fuerza con la que el núcleo atrae a los electrones de valencia disminuye a medida que bajamos en un grupo, disminuyendo así mismo la energía de ionización.
¿Cómo determinar la energía de ionización?
La energía de ionización es una cantidad determinada experimentalmente por medio de una serie de técnicas llamadas, en conjunto, espectroscopia de fotoelectrones.
Estas técnicas se basan en un fenómeno muy similar al efecto fotoeléctrico, en el cual la radiación electromagnética es capaz de arrancar los electrones de un átomo, y la diferencia entre la energía de la radiación y la energía cinética con la que es despedido electrón representa la energía de ionización.
Las distintas técnicas de espectroscopia de fotoelectrones permiten analizar las energías de con las que prácticamente cualquier electrón está enlazado a su núcleo, sea este un electrón de valencia o un electrón interno.
Ejemplos de energía de ionización
Primeras energías de ionización de los gases nobles
Los gases nobles poseen las configuraciones electrónicas más estables de todos los elementos de la tabla periódica. Por esta razón, también poseen las mayores energías de ionización. A continuación se presenta la primera energía de ionización de cada uno de los gases nobles:
Helio
Su primera energía de ionización es de 2373 kJ/mol, la más alta de toda la tabla periódica.
Neón
Su primera energía de ionización es de 2080 kJ/mol y es la segunda más alta.
Argón
Su primera energía de ionización es de 1521 kJ/mol. Solo el F, el Ne y el He tienen energías de ionización mayores.
Kriptón
La primera energía de ionización es 1350 kJ/mol. No es tan alta como las demás, pero sigue siendo mayor que la de sus elementos vecinos.
Xenón
Lo mismo que se dice del kriptón se puede decir del xenón con su primera energía de ionización de 1170 kJ/mol.
Primeras y segundas energías de ionización de los metales alcalinos
Los metales alcalinos tienen a su vez la menor primera energía de ionización y la mayor segunda energía de ionización de todos los elementos:
Litio
Su primera energía de ionización es menos de la cuarta parte de la del he, pero el litio tiene la mayor segunda energía de ionización de todos los elementos, la cual es de 7300 kJ/mol.
Sodio
El sodio pierde muy fácilmente su primer electrón, ya que con ello adquiere la configuración electrónica del Ne, pero para eliminar el segundo electrón hay que suministrar 4560kJ/mol.
Potasio
La primera energía de ionización del potasio es de tan solo 418,7 kJ/mol, mientras que la segunda es de 3052 kJ/mol, considerablemente mayor que la de sus vecinos.
Rubidio
Con una energía de ionización de 403 kJ/mol, el rubidio es uno de los elementos con menor energía de ionización. Sin embargo, la segunda es de 2633 kJ/mol.
Cesio
Su primera energía de ionización es de tan solo 375 kJ/mol y la segunda 2234 kJ/mol, incluso menor que la primera energía de ionización del helio.
