Sales orgánicas: qué son, propiedades, usos, ejemplos
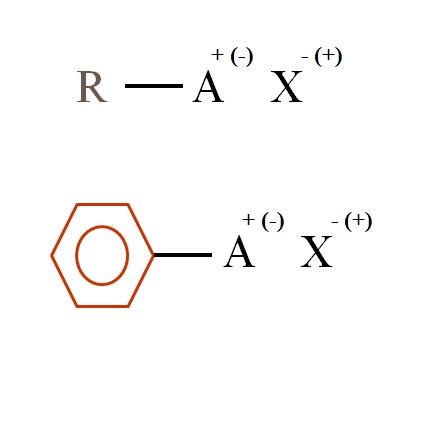
¿Qué son las sales orgánicas?
Las sales orgánicas son un denso número de compuestos iónicos con innumerables características. Derivan previamente de un compuesto orgánico, el cual ha sufrido una transformación que le permite ser portador de una carga, y que además, su identidad química depende del ion asociado.
En la imagen superior se muestran dos fórmulas químicas muy generales para las sales orgánicas. La primera de ellas, R-AX, se interpreta como un compuesto en cuya estructura carbonada un átomo, o grupo A, porta una carga positiva + o negativa (-).
Como puede apreciarse, existe un enlace covalente entre R y A, R-A, pero a su vez, A tiene una carga formal que atrae (o repele) al ion X. El signo de la carga dependerá de la naturaleza de A y del entorno químico.
Si A fuera positiva, ¿con cuántos X podría interactuar? Con uno solo, dado el principio de electroneutralidad (+1-1=0). Sin embargo, ¿cuál es la identidad de X? El anión X podría ser el CO32–, requiriendo de dos cationes RA+; un halogenuro: F–, Cl–, Br–, etc.; o incluso, otro compuesto RA–. Las opciones son incalculables.
Asimismo, una sal orgánica puede tener carácter aromático, ilustrado en el anillo bencénico de color marrón. La sal benzoato de cobre (II), (C6H5COO)2Cu, por ejemplo, consiste en dos anillos aromáticos con grupos carboxilos cargados negativamente, los cuales interactúan con el catión Cu2+.
Propiedades físicas y químicas de las sales orgánicas
De la imagen se puede afirmar que las sales orgánicas constan de tres componentes: el orgánico, R o Ar (el anillo aromático), un átomo o grupo portador de la carga iónica A, y un contraión X.
Así como la identidad y estructura química vienen definidas por tales componentes, del mismo modo sus propiedades dependen de ellos.
A partir de este hecho se pueden resumir ciertas propiedades generales que cumplen la gran mayoría de estas sales.
Masas moleculares altas
Asumiendo aniones X inorgánicos mono o polivalentes, las sales orgánicas suelen tener masas moleculares mucho más grandes que las sales inorgánicas. Esto se debe principalmente al esqueleto carbonado, cuyos enlaces simples C-C, y sus átomos de hidrógenos, aportan mucha masa al compuesto.
Por lo tanto, son R o Ar los responsables de sus altas masas moleculares.
Anfifílicos y surfactantes
Las sales orgánicas son compuestos anfifílicos, es decir, sus estructuras poseen tanto extremos hidrofílicos como hidrofóbicos.
¿Cuáles son tales extremos? R o Ar representan el extremo hidrofóbico, debido a que sus átomos de C y H no tienen gran afinidad por las moléculas de agua.
A+(-), el átomo o grupo portador de la carga, es el extremo hidrofílico, ya que contribuye al momento dipolar e interactúa con el agua formando dipolos (RA+ OH2).
Cuando las regiones hidrofílicas e hidrofóbicas se encuentran polarizadas, la sal anfifílica se convierte en un surfactante, sustancia ampliamente utilizada para la elaboración de detergentes y desemulsificantes.
Puntos de ebullición o fusión altos
Al igual que las sales inorgánicas, las sales orgánicas tienen también altos puntos de fusión y ebullición, debido a las fuerzas electrostáticas que gobiernan en fase líquida o sólida.
Sin embargo, al haber un componente orgánico R o Ar, participan otros tipos de fuerzas de Van der Waals (fuerzas de London, dipolo-dipolo, puentes de hidrógeno) que compiten de cierto modo con las electrostáticas.
Por esta razón, las estructuras sólidas o líquidas de las sales orgánicas son, en primera instancia, más complejas y variadas. Algunas de ellas inclusive pueden comportarse como cristales líquidos.
Acidez y basicidad
Las sales orgánicas por lo general son ácidos o bases más fuertes que las sales inorgánicas. Esto se debe a que A, por ejemplo en las sales de amina, posee una carga positiva debido a su enlace con un hidrógeno adicional: A+-H. Entonces, en contacto con una base, dona el protón para volver a ser un compuesto neutro:
RA+H + B => RA + HB
El H pertenece a A, pero se escribe, ya que interviene en la reacción de neutralización.
Por otro lado, RA+ puede tratarse de una molécula grande, incapaz de formar sólidos con una red cristalina lo suficientemente estable con el anión hidroxilo u oxhidrilo OH–.
Cuando esto es así, la sal RA+OH– se comporta como una base fuerte; incluso tan básica como el NaOH o el KOH:
RA+OH– + HCl => RACl + H2O
Nótese en la ecuación química que el anión Cl– sustituye al OH–, formando la sal RA+Cl–.
Usos de las sales orgánicas
El uso de las sales orgánicas variará de acuerdo con la identidad de R, Ar, A y X. Más aún, la aplicación a que se destinen también depende del tipo de sólido o líquido que forman. Algunas generalidades al respecto son:
- Sirven como reactivos para la síntesis de otros compuestos orgánicos. RAX puede actuar como un “dador” de la cadena R para que se adicione a otro compuesto sustituyendo a un buen grupo saliente.
- Son surfactantes, por lo que también pueden utilizarse como lubricantes. Las sales metálicas de carboxilatos se usan para este propósito.
- Permiten sintetizar una amplia gama de colorantes.
Ejemplos de sales orgánicas
Carboxilatos
Los ácidos carboxílicos reaccionan con un hidróxido en una reacción de neutralización, originando las sales de carboxilatos: RCOO– M+; donde M+ puede ser cualquier catión metálico (Na+, Pb2+, K+, etc.) o el catión amonio NH4+.
Los ácidos grasos son ácidos carboxílicos de cadena alifática larga, pueden ser saturados e insaturados. Están entre los saturados el ácido palmítico (CH3(CH2)14COOH). Este origina la sal palmitato, mientras que el ácido esteárico (CH3(CH2)16COOH forma la sal estearato. Los jabones se constituyen de estas sales.
Para el caso del ácido benzoico, C6H5COOH (donde C6H5– es un anillo bencénico), cuando reacciona con una base forma las sales de benzoato. En todos los carboxilatos el grupo -COO– representa a A (RAX).
Diaquilcupratos de litio
El diaquilcuprato de litio es útil en la síntesis orgánica. Su fórmula es [R-Cu-R]–Li+, en la cual el átomo de cobre porta una carga negativa. Aquí, el cobre representa al átomo A de la imagen.
Sales de sulfonio
Se forman a partir de la reacción de un sulfuro orgánico con un halogenuro de alquilo:
R2S + R’X => R2R’S+X
Para estas sales, el átomo de azufre porta una carga formal positiva (S+) al tener tres enlaces covalentes.
Sales de oxonio
Asimismo, los éteres (los análogos oxigenados de los sulfuros) reaccionan con los hidrácidos para formar las sales de oxonio:
ROR’ + HBr => RO+HR’ + Br–
El protón ácido de HBr se enlaza covalentemente al átomo de oxígeno del éter (R2O+-H), cargándolo positivamente.
Sales de amina
Las aminas pueden ser primarias, secundarias, terciarias o cuaternarias, al igual que sus sales. Todas ellas se caracterizan por tener un átomo de H enlazado al átomo de nitrógeno.
Así, RNH3+X– es una sal de amina primaria; R2NH2+X–, de amina secundaria; R3NH+X–, de amina terciaria; y R4N+X–, de amina cuaternaria (sal de amonio cuaternario).
Sales de diazonio
Por último, las sales de diazonio (RN2+X–) o arildiazonio (ArN2+X–), representan el punto de partida de muchos compuestos orgánicos, en especial, los colorantes azoicos.
Referencias
- Francis A. Carey. Química Orgánica (Sexta edición, pp. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organic Chemistry. Amines (10th edition.). Wiley Plus.
- Wikipedia (2018). Salt (Chemistry). Tomado de: en.wikipedia.org
- Steven A. Hardinger (2017). Illustrated Glossary of Organic Chemistry: salts. Recuperado de: chem.ucla.edu
- Chevron Oronite (2011). Carboxylates. [PDF]. Recuperado de: oronite.com
