¿Qué es un proceso isotérmico? (Ejemplos, ejercicios)
El proceso isotérmico o isotermo es un proceso termodinámico reversible en el cual la temperatura permanece constante. En un gas, hay situaciones en las que un cambio en el sistema no produce variaciones en la temperatura, pero sí en las características físicas.
Estos cambios son los cambios de fase, cuando la sustancia cambia de sólido a líquido, de líquido a gas o viceversa. En tales casos, las moléculas de la sustancia reajustan su posición, agregando o extrayendo energía térmica.

La energía térmica necesaria para que ocurra un cambio de fase en una sustancia se denomina calor latente o calor de transformación.
Una forma de conseguir que un proceso sea isotérmico es poner en contacto la sustancia que será el sistema en estudio con un depósito térmico externo, que es otro sistema de gran capacidad calórica. De esta forma ocurre un intercambio de calor tan lento, que la temperatura se mantiene constante.
Este tipo de procesos se da con frecuencia en la naturaleza. Por ejemplo, en los seres humanos cuando la temperatura corporal aumenta o desciende nos sentimos enfermos, porque en nuestro organismo numerosas reacciones químicas que mantienen la vida se dan a temperatura constante. Esto es válido para los animales de sangre caliente en general.
Otros ejemplos son el del hielo que se derrite con el calor al llegar la primavera y los cubos de hielo que enfrían la bebida.
Índice del artículo
- 1 Ejemplos de procesos isotérmicos
- 2 Cálculo del trabajo realizado en un proceso isotérmico
- 3 Referencias
-El metabolismo de los animales de sangre caliente se lleva a cabo a temperatura constante.

-Cuando el agua hierve ocurre un cambio de fase, de líquido a gas, y la temperatura se mantiene constante a 100 º C aproximadamente, ya que otros factores pueden influir en el valor.
-El hielo que se derrite es otro proceso isotérmico frecuente, al igual que colocar agua en el congelador para hacer cubos de hielo.
-Los motores de automóvil, los refrigeradores, así como muchos otros tipos de maquinaria, operan correctamente en cierto rango de temperatura. Para mantener la temperatura apropiada se utilizan dispositivos llamados termostatos. En su diseño se utilizan diversos principios de funcionamiento.
Un motor de Carnot es una máquina ideal de la cual se obtiene trabajo gracias a procesos enteramente reversibles. Es una máquina ideal porque no considera procesos que disipan energía, como viscosidad de la sustancia que hace el trabajo, ni tampoco rozamientos.
El ciclo de Carnot consta de cuatro etapas, dos de las cuales son precisamente isotérmicas y las otras dos adiabáticas. Las etapas isotérmicas son de compresión y expansión de un gas que se encarga de producir el trabajo útil.
Un motor de automóvil opera con principios parecidos. El movimiento de un pistón en el interior del cilindro se transmite hacia otras partes del automóvil y produce movimiento. No tiene el comportamiento de un sistema ideal como el del motor de Carnot, pero los principios termodinámicos son comunes.
Para calcular el trabajo hecho por un sistema cuando la temperatura es constante, hay que utilizar la primera ley de la termodinámica, que afirma:
ΔU = Q – W
Esta es otra forma de expresar la conservación de la energía en el sistema, presentada a través de ΔU o cambio en la energía, Q como el calor suministrado y por último W, que es el trabajo realizado por dicho sistema.
Supongamos que el sistema en cuestión es un gas ideal contenido en el cilindro de un émbolo móvil de área A, que hace trabajo cuando su volumenV cambia de V1 a V2.
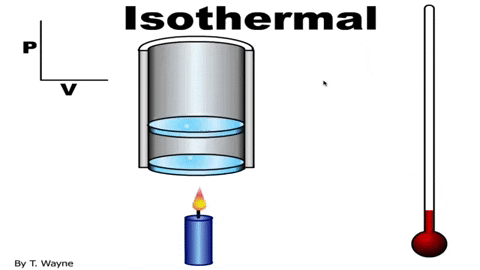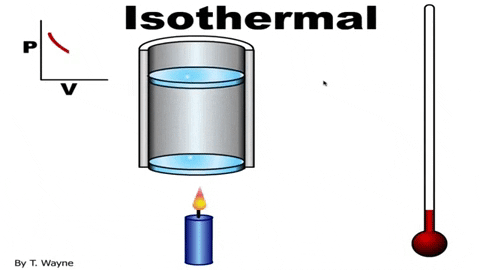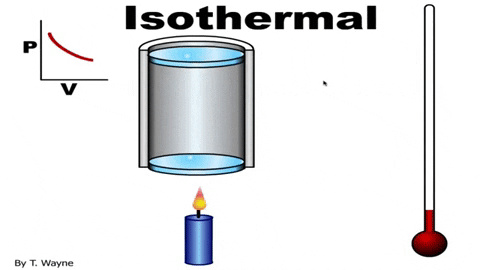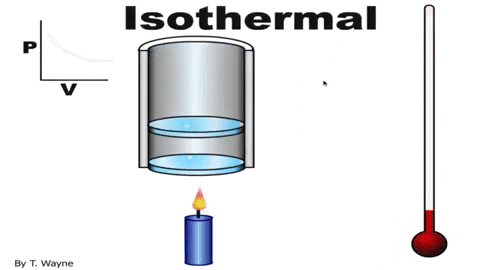
La ecuación de estado del gas ideal es PV=nRT, la cual relaciona el volumen con la presión P y la temperatura T. Los valores de n y R son constantes: n es el número de moles del gas y R la constante de los gases. En el caso de un proceso isotérmico el producto PV es constante.
Pues bien, el trabajo realizado se calcula integrando un pequeño trabajo diferencial, en el cual una fuerza F produce un pequeño desplazamiento dx:
dW= Fdx = PAdx
Como Adx es el precisamente la variación del volumen dV, entonces:
dW=PdV
Para obtener el trabajo total en un proceso isotérmico, se integra la expresión de dW:
La presión P y el volumen V se grafican en un diagrama P-V como el que se muestra en la figura y el trabajo realizado equivale al área bajo la curva:
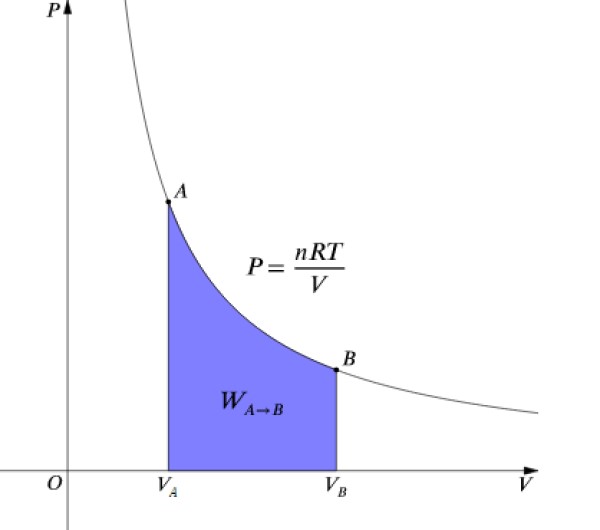
Como ΔU = 0 ya que la temperatura permanece constante, en un proceso isotérmico se tiene que:
Q=W
Un cilindro provisto de un pistón móvil contiene un gas ideal a 127 ºC. Si el pistón se mueve hasta reducir 10 veces el volumen inicial, manteniendo constante la temperatura, encuentre la cantidad de moles de gas contenidos en el cilindro, si el trabajo hecho sobre el gas es de 38.180 J.
Dato: R = 8.3 J/mol. K
Solución
El enunciado afirma que la temperatura se mantiene constante, luego estamos en presencia de un proceso isotérmico. Para el trabajo hecho sobre el gas se tiene la ecuación deducida previamente:
127 º C = 127 + 273 K = 400 K
Se despeja n, el número de moles:
n = W / RT ln(V2 / V1) = -38180 J / 8.3 J/mol.K x 400 K x ln (V2/10V2) = 5 moles
Al trabajo se le antepuso un signo negativo. El lector atento habrá notado en la sección precedente que W se definió como “el trabajo hecho por el sistema” y lleva signo +. Entonces el “trabajo hecho sobre el sistema” lleva signo negativo.
Se tiene aire en un cilindro provisto de un émbolo. Inicialmente hay 0.4 m3 de gas a presión 100 kPa y 80 º C de temperatura. El aire se comprime a 0.1 m3 asegurándose de que la temperatura en el interior del cilindro permanezca constante durante el proceso.
Determine cuánto trabajo se hace durante este proceso.
Solución
Empleamos la ecuación para el trabajo deducida previamente, pero se desconoce el número de moles, que se puede calcular con la ecuación de los gases ideales:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = P1V1 /RT = 100000 Pa x 0.4 m3 /8.3 J/mol. K x 353 K = 13.65 mol
W = n.R.T ln(V2/V1) = 13.65 mol x 8.3 J/mol. K x 353 K x ln (0.1 /0.4) = -55.442,26 J
Nuevamente el signo negativo indica que se hizo trabajo sobre el sistema, lo que siempre sucede cuando se comprime el gas.
- Bauer, W. 2011. Física para Ingeniería y Ciencias. Volumen 1. Mc Graw Hill.
- Cengel, Y. 2012. Termodinámica. 7ma Edición. McGraw Hill.
- Figueroa, D. (2005). Serie: Física para Ciencias e Ingeniería. Volumen 4. Fluidos y Termodinámica. Editado por Douglas Figueroa (USB).
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach.
- Serway, R., Vulle, C. 2011. Fundamentos de Física. 9na Cengage Learning.
- Wikipedia. Isothermal Process. Recuperado de: en.wikipedia.org.
