Silicato de sodio (Na2SiO3): estructura, propiedades, usos, riesgos
El silicato de sodio es un compuesto inorgánico formado por dos iones sodio Na+ y un anión silicato SiO32–. También se dice que está formado por una molécula de sílice SiO2 y una de óxido de sodio Na2O. Su fórmula química puede expresarse como Na2SiO3 o también Na2O.SiO2.
Sin embargo, la composición del silicato de sodio puede variar dependiendo de la relación SiO2/Na2O en peso o en moles. Se le denomina también silicato soluble o vidrio soluble. Se puede obtener en forma de polvo, grandes trozos parecidos a cristales o en forma de soluciones.

El silicato de sodio tiene un amplio uso en detergentes y jabones pues permite suavizar el agua haciendo más efectiva la limpieza. También forma parte de productos como la crema de afeitar.
Es la materia prima para preparar catalizadores de sílice SiO2. Sus soluciones se emplean como pegamento en muchas aplicaciones, que van desde el papel adhesivo y cartones, hasta el vidrio, porcelana, moldes refractarios, cemento y discos abrasivos.
Por ser un material completamente no combustible, se usa para fabricar telas a prueba de fuego, pues es retardador del fuego, y como revestimiento de equipos de protección.
Índice del artículo
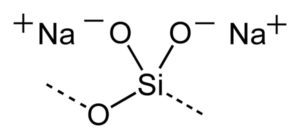
La fórmula general de los silicatos de sodio es xSiO2/Na2O donde x es la razón molar o en peso.
Razón molar significa número de moles de SiO2 dividido entre el número de moles de Na2O. Razón en peso quiere decir peso de SiO2 dividido entre peso de Na2O.
Añadiendo más álcali (Na2O) se cambia la relación molar o en peso.
Una solución de silicato de sodio con una relación molar baja, por ejemplo 1/1 (1 mol de SiO2 y 1 mol de Na2O) contiene principalmente monómeros SiO44– y dímeros S2O52– además de los iones Na+.
Una solución con una relación molar alta como por ejemplo 3,3/1 (3,3 moles de SiO2 por cada mol de Na2O) tiene una alta proporción de especies poliméricas o polímeros de silicio y oxígeno.
-Silicato de sodio
-Metasilicato de sodio
-Vidrio soluble
-Vidrio de agua (del inglés water glass)
-Silicato soluble
-Sólido en trozos grandes parecidos a cristales de color verde azulado
-Sólido en polvo de incoloro a blanco
-Soluciones acuosas incoloras.
De la fórmula Na2SiO3: 122,063 g/mol.
Na2SiO3: 1089 °C
Depende de la relación SiO2/Na2O.
Cuando se encuentra en forma de trozos grandes de cristal verdoso es soluble en agua si se calienta y bajo una alta presión. El polvo es ligeramente más soluble, pero en ambos casos su solubilidad depende de la cantidad de sodio o Na2O que posea.
Mientras mayor sea el contenido de sodio (en forma de Na2O) más rápido se disuelve.
Sus soluciones acuosas son fuertemente alcalinas.
Comercialmente se prepara en relaciones SiO2/Na2O en peso que van desde 1,5 hasta 3,3. A medida que aumenta el SiO2 en la relación disminuye la solubilidad en agua y la alcalinidad.
Al disolver el silicato sólido en agua se pueden formar mezclas gelatinosas o muy viscosas.
El polvo de silicato de sodio puede ser delicuescente, es decir, si tiene una alta cantidad de Na2O, tiende a absorber fácilmente agua del ambiente.
Si se disminuye el pH de sus soluciones agregándoles ácido se forma un gel.
No es inflamable.
Para obtener silicatos de sodio se funde arena de sílice SiO2 con carbonato de sodio Na2CO3 anhidro en un horno abierto. La relación molar de arena a carbonato de sodio puede variar comercialmente de 0,5 a 3,75.

Los silicatos de sodio están entre los primeros compuestos que fueron empleados en formulaciones de detergentes.

El silicato de sodio secuestra los iones calcio Ca2+ y magnesio Mg2+, eliminando lo que se llama dureza del agua, esto es, suavizándola. Al hacer esto se forman precipitados insolubles, por lo que se usa en pequeñas cantidades.
La acción del silicato de sodio permite al detergente funcionar sin que los iones mencionados afecten el proceso de limpieza.
Los geles de sílice se preparan comúnmente acidificando una solución de silicato de sodio a pH menor de 10 u 11. El tiempo requerido para gelificar varía.

Se puede preparar sílice mezclando silicato de sodio con un ácido mineral fuerte. El silicato de sodio se emplea en la manufactura de bases para catalizadores, ya que es la fuente de sílice SiO2.
Las soluciones acuosas concentradas de silicato de sodio se emplean como adhesivos y selladores. Pueden aguantar temperaturas de hasta 1100 °C.
Las principales aplicaciones de los pegamentos de silicato de sodio son en papel adhesivo, cartón corrugado u ondulado, cajas y cartones. También para pegar o aglomerar madera o para adherir metal a varios tipos de materiales.

Sirve para pegar vidrio, porcelana, cerámica, textiles, cuero, etc. Para unir fibra de vidrio, vidrios ópticos y recipientes de vidrio a prueba de impactos.
Permite preparar cementos refractarios para construir tanques, hervidores, hornos y moldes para fundición de metales, así como para hacer morteros o cementos a prueba de agua o de ácidos.
Los silicatos de sodio pueden reaccionar con fluoruros de silicio para producir cementos resistentes a los ácidos, con baja tendencia a la contracción y una expansión térmica similar a la del acero.
También se emplean para hacer cementos para discos abrasivos utilizados para pulir.
El silicato de sodio se ha utilizado durante muchos años como lechada química durante la perforación de cierto tipo de formaciones con muy alta permeabilidad, como por ejemplo las que están constituidas por arena.
Alta permeabilidad significa que deja pasar los líquidos fácilmente.
Se añade junto con un compuesto que activa al silicato para formar un polímero. Este polímero proporciona fuerza, rigidez y reduce la permeabilidad en suelos granulares.
Al ser el suelo menos permeable, el líquido no lo atraviesa libremente y de esta forma se evita la pérdida de fluido durante la fase de perforación del pozo.
El silicato de sodio tiene además una variedad de usos. A continuación se mencionan algunos.
-En productos de cuidado diario, por ejemplo es componente de cremas de afeitar.
-En tratamiento de aguas.
-En el blanqueamiento de textiles como la lana.
-En el blanqueamiento de pulpa de papel. Por ejemplo, para blanquear madera molida se usa una mezcla que contiene peróxido de hidrógeno y silicato de sodio entre otros ingredientes. El silicato de sodio se usa para secuestrar los iones metálicos, los cuales tienden a acelerar la descomposición del peróxido.
-Para la manufactura de telas a prueba de fuego. Como retardador de fuego y como revestimiento de equipos de protección.
-En pigmentos de sílice.
-Para detectar granos de maíz infestados por insectos. Se emplea una mezcla de silicato de sodio y agua en donde los granos infestados flotan sobre la superficie rápidamente.
-En la electrodeposición de cinc.
-Para limpiar metales.
-En la flotación de minerales se emplea como dispersante de lodos y limo y como acondicionador de la superficie de los minerales.
-Para impregnar madera.
El silicato de sodio por su alto contenido de álcali es un fuerte irritante de la piel, los ojos y las membranas mucosas. Si se ingiere puede ser tóxico e irritar las membranas mucosas de forma similar a soluciones de soda cáustica.
Debe almacenarse separado de ácidos fuertes, metales y halógenos como el flúor, con el cual reacciona violentamente.
- Ebnesajjad, S. (2015). Characteristics of Adhesive Materials. Soluble Silicates (Potassium and Sodium Silicate). In Handbook of Adhesives and Surface Preparation. Recuperado de sciencedirect.com.
- Fink, J.K. (2012). Fluid loss additives. Sodium metasilicate. In Petroleum Engineer´s Guide to Oil Field Chemicals and Fluids (Second Edition). Recuperado de sciencedirect.com.
- U.S. National Library of Medicine. (2019). Sodium silicate. National Center for Biotechnology Information. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer. (1984). Encyclopedia of Chemical Technology, 3rd ed., John Wiley and Sons.
- Maeda, K. et al. (2007). From Zeolites to Porous MOF Materials – The 40th Anniversary of International Zeolite Conference. In Studies in Surface Science and Catalysis. Recuperado de sciencedirect.com.
- Chopade, S.P. and Nagarajan, K. (2000). Detergent formulations: ion exchange. In Encyclopedia of Separation Science. Recuperado de sciencedirect.com.
- Garcia-Lodeiro, I. et al. (2015). Crucial insights on the mix design of alkali-activated cement-based binders. Effect of silicates: degree of soluble silicate polymerization. In Handbook of Alkali-Activated Cements, Mortars and Concretes. Recuperado de sciencedirect.com.
