Silicato de calcio: propiedades, estructura, obtención, usos
El silicato de calcio es el nombre que se le asigna a un grupo de compuestos químicos formados a partir de óxido de calcio (CaO) y sílice (SiO2). La fórmula general de estos compuestos es xCaO•ySiO2•zH2O.
Son sólidos blancos o blanco amarillentos. Pueden ser anhidros, es decir, sin agua (H2O) en su estructura, o pueden contenerla. Forman parte de varios tipos de minerales en la naturaleza.

Los silicatos de calcio son insolubles en agua pero al unirse con esta forman geles hidratados (materiales como gelatina) que luego al cuajar son muy duros, resistentes y casi impermeables.
Esto ha causado su uso en la industria de la construcción, pues se utilizan en el cemento, en ladrillos y en paneles aislantes de la humedad. También forman parte de materiales para curar perforaciones en los dientes e incluso se ha estudiado para utilizarlos en la regeneración de huesos, es decir, como biomaterial.
Se han propuesto para disminuir la contaminación que generan algunas industrias metalúrgicas. También se emplean como generadores de fricción en frenos y embragues de vehículos.
Índice del artículo
El silicato de calcio puede contener una cantidad variable de óxido de calcio (CaO) y de sílice (SiO2). Su fórmula general es:
xCaO•ySiO2•zH2O
donde x, y, y z son números que pueden tener diversos valores.
La cantidad de CaO debe estar entre el 3% y 35% (en peso sobre base seca) y el contenido de SiO2 debe ser de 50-95% (en peso sobre base seca). Pueden ser anhidros (sin agua en su estructura, es decir, z=0 en la fórmula) o pueden ser hidratados (con agua es su conformación).
- Silicato de calcio
- Sal de calcio del ácido silícico
- Óxido de calcio y silicio
Sólido muy fino blanco o blanco hueso.
Metasilicato de calcio CaO•SiO2 o CaSiO3 = 116,16 g/mol
Metasilicato de calcio CaSiO3 =1540 °C
Metasilicato de calcio CaSiO3 = 2,92 g/cc
Insoluble en agua y etanol.
Un lodo preparado con un 5% de silicato de calcio puede tener un pH de 8,4-12,5.
El silicato de calcio puede ser hidratado (con agua en la molécula) o anhidro (sin agua en la molécula) con varias proporciones de calcio en forma de óxido de calcio CaO y sílice en forma de dióxido de sílice SiO2.
Posee una alta capacidad de absorción de agua. El metasilicato de calcio (CaO•SiO2 o CaSiO3) destaca por su brillantez y blancura, baja humedad, bajo contenido volátil y buena absorción de aceite.

Entre los hidratos de silicato de calcio se distinguen los formados al añadir agua al Ca2SiO5 y al Ca3SiO5. Los productos de hidratación de estos dos compuestos son los más abundantes en ciertos tipos de cemento.
El silicato de calcio se obtiene de varias formas haciendo reaccionar material silíceo (como las tierras de diatomeas) y compuestos de calcio (como el hidróxido de calcio (Ca(OH)2).
Se puede preparar silicato de calcio por ejemplo calcinando óxido de calcio (CaO) con sílice (SiO2) a temperaturas elevadas.
Cuando la reacción se realiza a una razón molar 1:1 (esto significa que hay igual número de moléculas de CaO que de SiO2) resulta el metasilicato de calcio CaSiO3 o CaO•SiO2:
CaO + SiO2 + calor → CaSiO3
Con el silicato de calcio se fabrican unidades o ladrillos para la construcción. Se obtienen con material silíceo fino y cal viva o cal hidratada. Se pueden añadir pigmentos inertes para dar diferente color al ladrillo.
Se moldean las unidades bajo presión y se curan en autoclave (horno con vapor) a 170 °C durante 4-6 horas. Durante el curado algo de la cal reacciona con el material silíceo para formar un hidrato de silicato de calcio, el cual mantiene unido al ladrillo.

Sin embargo, los ladrillos de silicato de calcio tienden a expandirse y encogerse más que los ladrillos de arcilla, lo que a veces puede causar agrietamiento de la mampostería.
Esto ha llamado la atención y se les ha considerado como potencialmente peligrosos.
Los silicatos de calcio forman parte del cemento Portland, que es un material que se usa ampliamente en la industria de la construcción.
El cemento Portland es un cemento hidráulico que se produce pulverizando materiales formados principalmente por silicatos de calcio hidratados y sulfato de calcio CaSO4 (yeso).

Se endurece rápidamente debido a la reacción de hidratación que genera un gel hidratado de silicatos de calcio. Esto resulta en un material fuerte, denso y poco permeable (que no deja pasar el agua).
Los silicatos que contiene son el silicato tricálcico Ca3SiO5 o 3CaO.SiO2 y el silicato dicálcico Ca2SiO4 o 2CaO.SiO2.
Los silicatos de calcio en el cemento pueden variar en su porcentaje en peso. La composición del cemento Portland puede cambiar según el tipo de estructura de construcción a la cual está destinado.
Algunos tipos de este cemento se utilizan para la inmovilización de basura radiactiva para que no cause daño a personas o al ambiente.
El silicato de calcio sirve para obtener tableros de espuma mineral o tableros minerales aislantes.

Estos sirven para aislar las paredes de la humedad. Se mezclan CaO y SiO2 con agua y se agrega un 3-6% de celulosa, lo que le mejora la flexibilidad y estabilidad de los bordes.
El lodo resultante se vierte en moldes y luego se calienta con vapor a alta presión y temperatura en un horno especial con vapor llamado autoclave.
El resultado es una espuma rígida, de poro muy fino que se corta en láminas o tableros y se trata con aditivos especiales para que pueda repeler el agua.
La espuma de silicato de calcio se usa en el sector de la construcción, especialmente para aislar las paredes y mejorar la protección contra la humedad, siendo útil especialmente en la renovación de edificios viejos.
El silicato dicálcico Ca2SiO4 o 2CaO.SiO2 que se encuentra en las escorias o desechos de la producción del acero se ha empleado para precipitar metales disueltos en efluentes ácidos de otros procesos metalúrgicos.
Precipitar significa que el metal disuelto pasa a formar parte de un compuesto sólido que se va al fondo del recipiente y se puede recoger.

El Ca2SiO4 presente en la escoria de acero reacciona con el agua y produce Ca(OH)2 que tiene la capacidad de neutralizar la acidez de las soluciones ácidas de metales de otros procesos:
2 Ca2SiO4 + 4 H2O → 3CaO.2SiO2.3H2O + Ca(OH)2
Además de neutralizar, el compuesto de silicato de calcio puede adsorber algunos de los iones metálicos M2+ por intercambio con el ion calcio Ca2+. A continuación un esquema:
≡Si-O-Ca + M2+ → ≡Si-O-M + Ca2+
El compuesto sólido que contiene el metal puede luego ser utilizado para otra finalidad y no se desecha. Este es un ejemplo de ecología industrial.
Las cerámicas de silicatos de calcio se empezaron a probar como biomateriales desde 1990. Se han estudiado para su uso potencial en la regeneración de tejido óseo debido a que poseen una bioactividad superior a otros materiales.
Se atribuye esto al hecho de que tienen silicio (Si), el cual juega un papel esencial en los mecanismos que conducen a la formación de hueso nuevo.
Los cementos basados en silicatos de calcio tienen la capacidad de inducir la formación de recubrimiento de fosfato de calcio/apatita cuando son sumergidos en fluidos biológicos y promover la regeneración de tejidos.
Por estas razones está siendo considerado como material adecuado para la reparación de huesos.
El silicato de calcio forma parte de la biodentina. Este es un material que se utiliza para reparar perforaciones de dientes, reabsorciones de huesos y como relleno del extremo de las raíces de los dientes.
La biodentina es un cemento bioactivo con poca porosidad que posee una fuerza o dureza mecánica mayor que otros materiales y se asemeja a la dentina.
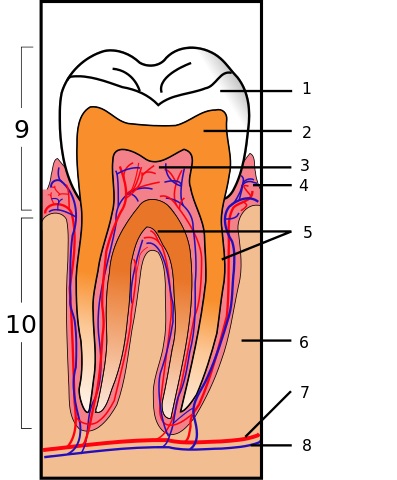
Está formada por silicato tricálcico (Ca3SiO5), silicato dicálcico (Ca2SiO5), carbonato de calcio (CaCO3) y óxido de circonio. Al mezclarse con agua los silicatos cálcicos forman un gel hidratado pegajoso que tras un tiempo solidifica creando una estructura dura.
Ejerce un efecto positivo sobre las células de la pulpa dental y acelera la formación de puentes en la dentina, donde resalta la fuerza de sus enlaces, su microdureza y resistencia a la compresión.
Los silicatos de calcio se utilizan también como agentes antiapelmazantes y ayudantes de filtración.
El metasilicato de calcio CaSiO3 se usa en cerámicas, en dispositivos donde se requiere cierta fricción, como frenos y embragues de vehículos, y en la obtención de metales.
Por su alta brillantez y blancura el CaSiO3 se emplea en relleno de pinturas y plásticos.
- Ropp, R.C. (2013). Group 14 (C, Si, Ge, Sn, and Pb) Alkaline Earth Compounds. Calcium Silicates. In Encyclopedia of the Alkaline Earth Compounds. Recuperado de sciencedirect.com.
- FAO (2015). Calcium Silicate. Specifications prepared at the 80th JECFA (2015) and published in FAO JECFA Monographs 17. Recuperado de fao.org.
- Harrisson, A.M. (2019). Constitution and Specification of Portland Cement. Calcium Silicate Hydrate. In Lea’s Chemistry of Cement and Concrete (Fifth Edition). Recuperado de sciencedirect.com.
- Gellert, R. (2010). Inorganic mineral materials for insulation in buildings. Calcium silicate foam and mineral foam. In Materials for Energy Efficiency and Thermal Comfort in Buildings. Recuperado de sciencedirect.com.
- Goudouri, O-M. et al. (2016). Cgaracterizing the degradation behavior of bioceramic scaffolds. Apatite/wollastonite scaffolds. In Characterisation and Design of Tissue Scaffolds. Recuperado de sciencedirect.com.
- Rani, P. et al. (2019). Dental pulp capping nanocomposites. Biodentin. In Applications of Nanocomposite Materials in Dentistry. Recuperado de sciencedirect.com.
- Ingham, J.P. (2013). Concrete products. Calcium silicate units. In Geomaterials Under the Microscope. Recuperado de sciencedirect.com.
- Ojovan, M.I. and Lee, W.E. (2005). Immobilisation of Radioactive Wastes in Cement. Hydraulic Cements. In An Introduction to Nuclear Waste Immobilisation. Recuperado de sciencedirect.com.
- Ramachandra Rao, S. (2006). Resource Recovery and Recycling from Metallurgical Wastes. Calcium Silicate as Precipitant for Dissolved Metals. In Waste Management Series. Recuperado de sciencedirect.com.
- Prati, C. and Gandolfi, M.G. (2015). Calcium silicate bioactive cements: Biological perspectives and clinical applications. Dent Mater, 2015 Apr; 31(4):351-70. Recuperado de ncbi.nlm.nih.gov.
