Entalpía: cómo se calcula, tipos, ejemplos
¿Qué es la entalpía?
La entalpía es una propiedad termodinámica cuya variación, bajo condiciones de temperatura y presión constantes, determina la energía calórica de una sustancia o sistema asociada a una reacción química o proceso físico. Al ser una función de estado, se representa con la letra en mayúscula H, siendo ΔH su variación.
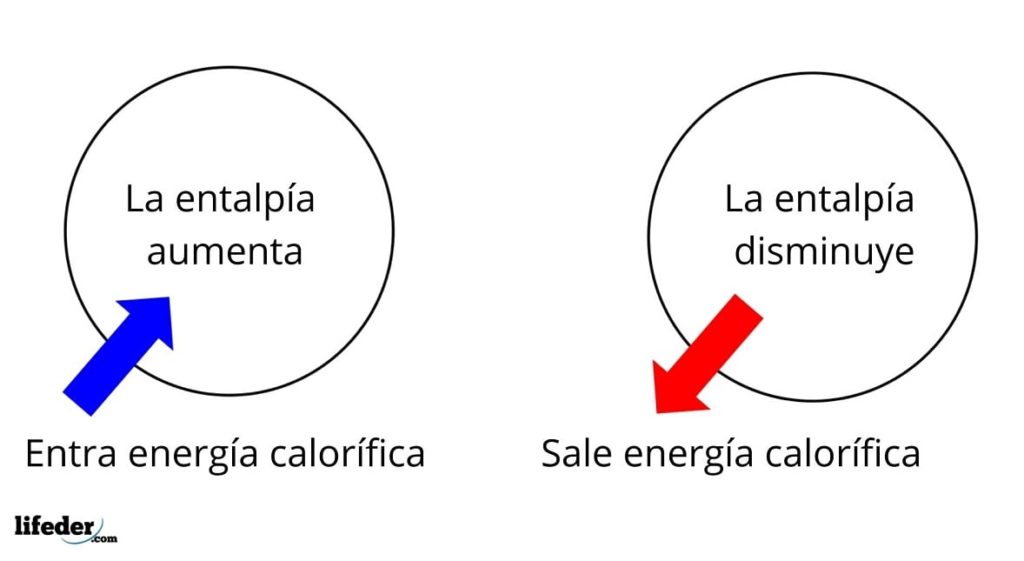
Es una de las propiedades extensivas más fundamentales para estudiar la termoquímica de muchas reacciones; es decir, hablamos del desprendimiento o absorción de calor entre el medio de reacción y sus alrededores. Así, decimos que una reacción es exotérmica si su ΔH es negativo (ΔH 0), o endotérmica si este por el contrario es positivo (ΔH > 0).

El hielo, por ejemplo, tiene una entalpía, Hhielo, mientras que el agua, también tiene una entalpía propia, Hagua. Cuando el hielo se derrite, ocurre una variación de entalpía, llamada ΔHfus o calor de fusión (Hagua-Hhielo). La entalpía del agua es superior a la del hielo, ocasionando que el ΔHfus para el hielo sea positivo y tenga un valor de +6.01 kJ/mol.
La entalpía y su variación se expresan, usualmente, en unidades de joule o calorías. El cambio de entalpía +6.01 kJ/mol señala que un mol de hielo debe absorber 6.01 kJ de energía calórica o calor para derretirse.
¿Cómo se calcula la entalpia?
Entalpía y su variación
La entalpía en sí misma es incalculable, debido a que depende de variables difíciles de medir con exactitud. Una buena comparación sería la de querer medir el volumen total de los océanos: siempre habrá porciones del mismo debajo de la tierra o esparcidas entre los continentes. Por eso, y en la práctica, H no puede determinarse; pero sí ΔH.
Para llegar a una expresión matemática que permita el cálculo de ΔH debe partirse primero de la definición fundamental de la entalpía:
H = U + PV
Siendo U la energía interna del sistema o de la sustancia en cuestión, y PV el trabajo presión-volumen que este sistema ejerce sobre los alrededores para poder existir. Como nos interesa calcular ΔH y no H, tenemos:
ΔH = ΔU + Δ(PV)
Si la presión es constante, la ecuación quedará como:
ΔH = ΔU + PΔV
Sabemos por otro lado que:
ΔU = q + w
Siendo q el calor y w el trabajo. Sustituyendo nos queda:
ΔH = q + w + PΔV
Pero además, sabemos que:
w = – PΔV
Y por lo tanto:
ΔH = q – PΔV + PΔV
ΔH = q
Es decir, que el ΔH para una reacción o proceso, realizada bajo presión constante, será igual al calor q generado o absorbido.
Cambios de entalpía de reacciones
La suposición de que la presión se mantiene constante es posible si la reacción ocurre bajo la atmósfera terrestre. Por ejemplo, el hielo de los paisajes invernales se derrite sin experimentar otra presión que la de nuestra atmósfera. Por otro lado, también aplica para reacciones en medios líquidos, o aquellas que no produzcan grandes cantidades de gases.
Estas reacciones absorben o liberan calor q igual a ΔH, que a su vez, es la diferencia de las entalpías entre los productos y reactantes:
ΔH = HProductos – HReactantes
Tipos de entalpía
Es una práctica común hablar de ΔH y H como si fueran lo mismo: a los dos se les llaman entalpías. No obstante, cuando se trata de los tipos, H es única para cada sustancia o sistema; mientras que ΔH, en cambio, sí está sujeta a la naturaleza de la reacción o proceso en sí mismos.
En este sentido, tenemos primeramente variaciones de entalpía positivas (ΔH >0) o negativas (ΔH 0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
El signo ‘+’ o ‘-’ que acompaña a ΔH nos dice por lo tanto si hay liberación o absorción de calor en determinada reacción o proceso; los cuales, tienen sus ΔH características, como parte de sus propiedades termoquímicas.
Tenemos pues, infinidades de tipos de entalpías, los cuales pueden clasificarse en función de los procesos físicos o las reacciones químicas.
Procesos físicos
Entalpía de cambio de fase
Las sustancias necesitan absorber o liberar calor para pasar de un estado o fase material (sólido, líquido o gas) a otro. Por ejemplo, el hielo absorbe calor para derretirse, por lo que la entalpía para este cambio de fase corresponde a la de fusión, ΔHfus, también denominada calor latente de fusión.
Entalpía de disolución o mezcla
Las sustancias cuando se disuelven o se mezclan en un medio disolvente pueden absorber o liberar calor, teniendo por lo tanto una entalpía ΔHdis o ΔHMezcla.
Reacciones químicas
Entalpía de formación
Es el calor asociado, ΔHºf, a la formación de un compuesto, específicamente un mol del mismo, a partir de sus elementos constituyentes en condiciones estándares de presión y temperatura (T= 298.15 K y P= 1 atm).
Entalpía de descomposición
Es el calor asociado, ΔHdes, a la degradación de un compuesto en sustancias más pequeñas y simples. Generalmente es positivo, pues se necesita calor para romper los enlaces de las moléculas.
Entalpía de hidrogenación
Es el calor asociado, ΔHh, a la adicción de una molécula de hidrógeno a un compuesto, usualmente un hidrocarburo.
Entalpía de combustión
Es el calor liberado, ΔHcomb, cuando una sustancia arde reaccionando con el oxígeno. Es negativo, pues se libera calor y luz (fuego).
Ejemplos de entalpías
Para finalizar se hará mención de algunos ejemplos concretos de entalpías:
Combustión del metano
CH4 + 2O2 → CO2 + 2H2O
ΔH = -890.3 kJ/mol
Es decir, que un mol de CH4 al combustionar libera 890.3 kJ de energía calórica.
Hidrogenación del etileno
CH2=CH2 + H2 → CH3CH3
ΔH = -136 kJ/mol
Un mol de etileno libera 136 kJ de calor cuando se hidrogena para convertirse en etano.
Disolución de la sal en agua
La sal de mesa, NaCl, se disuelve en el agua para separarse los iones Na+ y Cl– de las redes cristalinas y rodearse (hidratarse) de moléculas de agua:
NaCl(s) → Na+(ac) + Cl–(ac)
ΔH = +3.87 kJ/mol
Es decir, que disolviendo la sal en agua debería en consecuencia enfriar el vaso o recipiente. Sin embargo, la cantidad absorbida de calor es muy pequeña, por lo que apenas nuestras manos siquiera sentirán un leve cambio de temperatura.
Disolución de clorato de potasio en agua
Por otra parte, el clorato de potasio, KClO3, sí posee una ΔHdis muy positiva:
KClO3(s) → K+(ac) + ClO3–(ac)
ΔH = +41.38 kJ/mol
Lo que significa que para disolverse en el agua absorbe mucho calor. Y por lo tanto, el recipiente se enfriará notablemente, y veremos que el vapor del agua de los alrededores humedecerá su superficie externa.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Enthalpy. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (28 de agosto de 2020). Enthalpy Definition in Chemistry and Physics. Recuperado de: thoughtco.com
- Andrew Rader Studios. (2015). Energy and Enthalpy. Recuperado de: physics4kids.com
- Kiddle. (2020). Enthalpy facts for kids. Recuperado de: facts.kiddle.co
- Admin. (21 de diciembre de 2010). La Entalpía. Recuperado de: quimicaorganicaexplicada.com
- María Estela Raffino. (11 de julio de 2020). Concepto de Entalpía. Recuperado de: concepto.de
