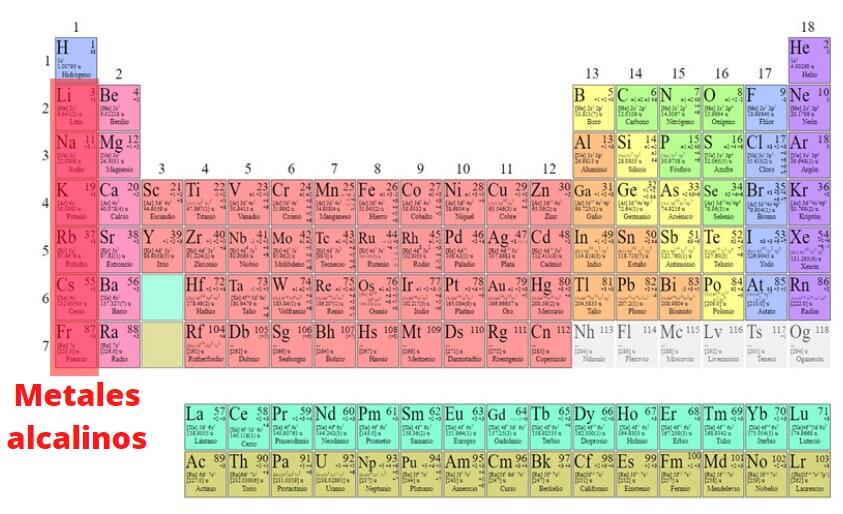
Metales alcalinos: propiedades físicas y químicas, usos, obtención
Los metales alcalinos son los elementos que forman parte del grupo I de la tabla periódica, excepto el hidrógeno: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). A diferencia de la mayoría de los metales, tienen bajas densidades y son muy reactivos. Debido a esta gran reactividad química, nunca se encuentran en la naturaleza en su forma elemental.
Estos metales forman compuestos iónicos simples y estables que, en su mayoría, son solubles en agua; los metales alcalinos suelen combinarse con iones halogenuro, sulfato, carbonato y silicato. Sin embargo, algunos elementos forman un número limitado de compuestos complejos y organometálicos.
En general, las propiedades físicas y químicas de los metales alcalinos han sido bien estudiadas, a excepción del francio debido a su naturaleza radioactiva.
Índice del artículo
- 1 Propiedades físicas
- 2 Propiedades químicas
- 3 Obtención de metales alcalinos
- 4 Principales usos y aplicaciones
- 5 Referencias
– Los metales alcalinos son plateados, excepto el cesio, que es dorado. Conducen electricidad y calor, y tienen puntos de fusión bajos que, además, disminuyen con el aumento del número atómico, porque el enlace entre los átomos se debilita al aumentar el radio atómico.
– El hecho de tener solo un electrón de valencia por átomo también hace que su enlace metálico sea débil. En consecuencia, los metales alcalinos también son lo suficientemente suaves como para cortarlos con un cuchillo o una espátula.
– Todos los elementos adoptan una estructura cúbica centrada en el cuerpo. Debido a que ese tipo de estructura cristalina no está empaquetada y los radios atómicos de los metales alcalinos son grandes, tienen densidades bajas en comparación con otros metales. De hecho, el litio, el sodio y el potasio flotan en el agua.
– Las diferencias de energía entre los orbitales de la capa de valencia de los metales alcalinos coinciden con longitudes de onda de la luz visible. Debido a esto, al calentar los compuestos formados por estos metales en una llama, se generan colores característicos.
– En orden descendente, las sales de litio dan un color carmesí, las sales de sodio un color amarillo, el potasio un color violeta, el rubidio un color rojo azulado y el cesio un color azul.
Todos los metales alcalinos presentan similitudes en sus propiedades químicas.
– Presentan una configuración electrónica de valencia ns1, que se traduce en un estado de oxidación +1. A su vez, esto significa que pierden con facilidad un electrón para alcanzar la configuración de gas noble.
– En general, los metales alcalinos tienen las energías de ionización más bajas de todos los elementos, que también disminuyen a medida que aumenta el radio atómico dentro del grupo porque la capa de valencia está cada vez más distante del núcleo. Esto explica la reactividad de los metales alcalinos y la formación de iones M+ en condiciones acuosas con facilidad.
– La tendencia termodinámica a formar iones M+ se confirma por los potenciales estándar de los pares M+/M, que son todos grandes y negativos. Tal tendencia implica que los metales alcalinos se oxidan fácilmente y pueden actuar como agentes reductores potentes.
– Estos elementos deben almacenarse en un aceite no reactivo para evitar la reacción con el oxígeno atmosférico. Aunque el litio, el sodio y el potasio pueden manipularse en el aire por períodos cortos, el rubidio y el cesio deben manejarse bajo una atmósfera inerte en todo momento.

La mejor forma de obtener sodio metálico involucra la electrólisis del cloruro de sodio fundido. Debido a que el punto de fusión del cloruro de sodio es bastante alto (808°C) y se requiere mucha energía para mantener grandes cantidades de la sustancia fundida, suele agregarse cloruro de calcio (CaCl2) para disminuir el punto de fusión hasta alrededor de 600°C.
El sodio se obtiene en estado líquido en el cátodo con una pureza del 99,95% bajo una atmósfera inerte.
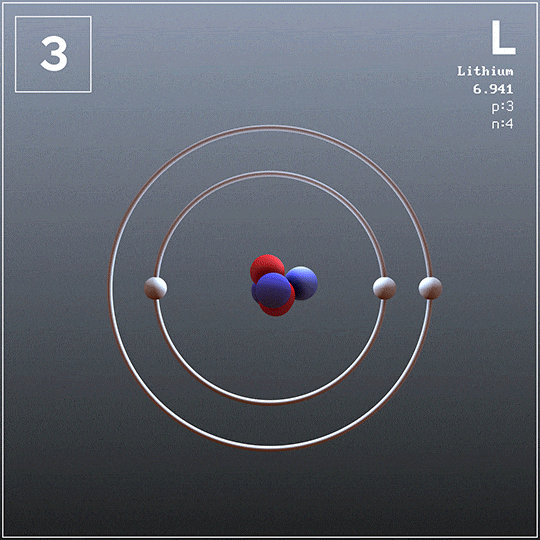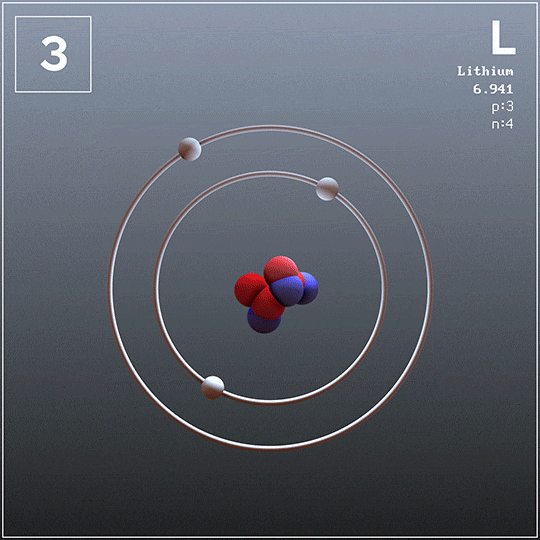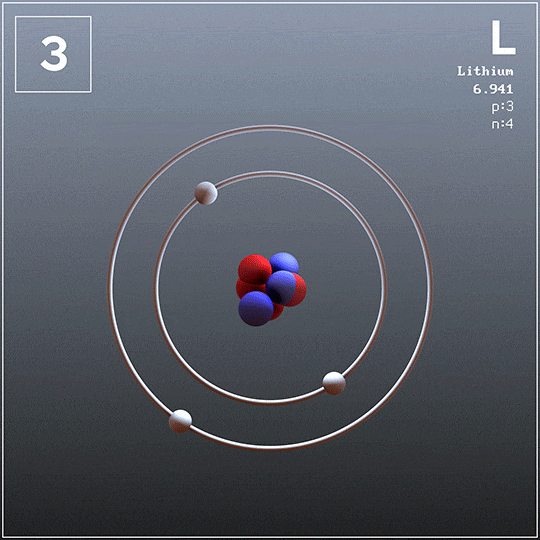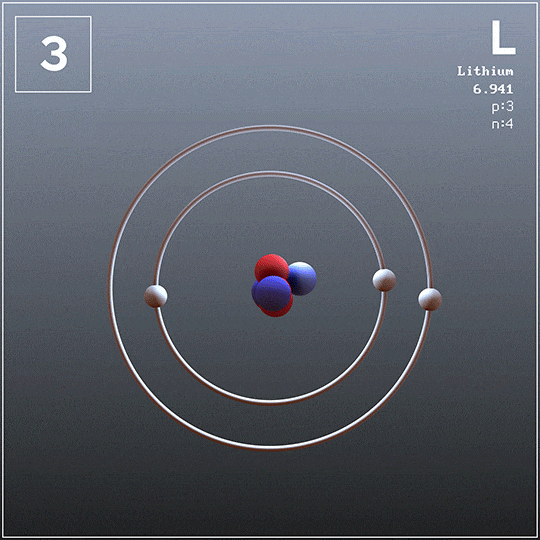
El litio también se puede obtener a partir de sus cloruros fundidos por electrólisis, pero no es el caso del potasio porque es demasiado soluble en el cloruro (KCl) y no flota en la superficie de la celda. Además, se evapora con facilidad a la temperatura de operación, por lo que crea condiciones peligrosas.
Por lo tanto, el potasio se obtiene por reducción de KCl fundido con sodio líquido. El sodio presente en el potasio se elimina condensando el vapor a 892°C y llevando a cabo una destilación fraccionada de los metales líquidos.
El rubidio y el cesio pueden obtenerse de modo similar, pero utilizando calcio como agente reductor. El cesio metálico también puede obtenerse por electrólisis de cianuro de cesio (CsCN) fundido.
Como el sodio se oxida con mucha facilidad, su aplicación más importante es como agente reductor para obtener metales como titanio, circonio y hafnio. También se utiliza como intercambiador de calor en reactores nucleares en su estado líquido.

La mayor parte del potasio que se procesa va a los fertilizantes en forma de cloruro de potasio. A su vez, el cloruro se usa en la producción de otros compuestos y soluciones como el hidróxido de potasio, que se usa en la fabricación de jabones líquidos.
El cianuro de potasio se usa para la extracción o recubrimiento de metales para facilitar la deposición de cobre, plata y oro. El potasio también se puede encontrar en algunos explosivos y como colorante de fuegos artificiales.
El litio metálico se utiliza como agente de aleación en la producción de aleaciones aeronáuticas y aeroespaciales de aluminio y magnesio. Pero con el paso del tiempo, ha encontrado cada vez mayor utilidad como ánodo de baterías alcalinas.
El litio metálico también permite reducir las temperaturas de fusión y sinterización de ciertos tipos de vidrios y cerámicas, además de disminuir su coeficiente de expansión. El carbonato de litio se usa ampliamente para tratar afecciones bipolares, mientras que el estearato de litio es un lubricante ampliamente utilizado en la industria automotriz.
El rubidio y el cesio suelen usarse en las mismas aplicaciones, por lo que uno de estos elementos puede ser sustituido por el otro. Las aplicaciones incluyen vidrio para fibra óptica en la industria de las telecomunicaciones, equipos de visión nocturna y células fotoeléctricas. El reloj de cesio (reloj atómico) se utiliza para la medida de tiempo estándar internacional y para la definición del segundo.
- Chang, R., & Goldsby, K. A. (2016). Chemistry (12th ed.). New York: Mc-Graw Hill.
- Halka, M., & Nordstrom, B. (2010). Alkali and Alkaline Earth Metals. New York: Infobase Publishing.
- Miessler, G. L., Fischer, P. J., & Tarr, D. A. (2014). Inorganic Chemistry (5th ed.). New York: Pearson.
- Mishra, B., & Majumdar, G. (2017). Alkali Metals Production (Li, Na, K). Reference Module in Materials Science and Materials Engineering. Elsevier.
- Petrucci, R. H., Herring, F. G., Bissonnette, C., & Madura, J. D. (2017). General Chemistry: Principles and Modern Applications (11th ed.). New York: Pearson.
- Shriver, D., Weller, M., Overton, T., Rourke, J., & Armstrong, F. (2014). Inorganic Chemistry (6th ed.). New York: W. H. Freeman.
