Enantiómeros: concepto, propiedades, nomenclatura, ejemplos

¿Qué son los enantiómeros?
Los enantiómeros son pares de compuestos que son imágenes especulares no superponibles el uno del otro. Estos pares de compuestos son un tipo particular de isómeros, es decir, que son compuestos diferentes que poseen la misma fórmula molecular.
Existen diferentes tipos de isómeros entre los que se encuentran los estereoisómeros, en los cuales todos los átomos están unidos en el mismo orden y con el mismo tipo de enlaces, pero tienen orientaciones diferentes en el espacio (estéreo significa espacio).
Dentro de los estereoisómeros, encontramos a los enantiómeros, cuya característica principal es la de ser imágenes especulares entre sí.
Los enantiómeros son muy comunes en la naturaleza. De hecho, casi la totalidad de los compuestos orgánicos presentes en las células de todos los seres vivos son uno de dos posibles enantiómeros.
Por ejemplo, todos los aminoácidos que forman parte de las proteínas naturales corresponden al enantiómero L del respectivo aminoácido (el otro isómero se identifica con la letra D).
Por otro lado, los principios activos de la gran mayoría de los medicamentos también existen como pares de enantiómeros, de los cuales solo uno es efectivo. La dificultad para separar enantiómeros entre sí hace que aquellos medicamentos que solo contienen el isómero útil sean muy costosos.
Enantiómeros y quiralidad
Los enantiómeros están formados por moléculas quirales. La quiralidad es la propiedad de no ser superponible con su imagen especular. La palabra quiral proviene del término griego, kheir que significa mano, recordando el hecho de que las manos también son imágenes especulares la una de la otra, y no se pueden superponer.

En vista de lo anterior, se puede deducir que por cada molécula quiral, debe existir otra molécula quiral que sea su imagen especular no superponible, es decir, su enantiómero. En otras palabras, siempre que se diga que una molécula es quiral, se sabe que se trata de uno de dos posibles enantiómeros.
Centros quirales
Muchos compuestos quirales poseen uno o más centros asimétricos que son responsables de la quiralidad de la molécula. Estos se denominan centros quirales y en muchos compuestos orgánicos consisten en átomos de carbono que están enlazados a 4 átomos o grupos de átomos diferentes.
La forma particular como se distribuyen estos cuatro grupos alrededor del carbono asimétrico determina a cuál de los dos enantiómeros corresponde una molécula quiral. La presencia de un solo centro quiral asegura que la molécula sea quiral, pero si hay más de uno, puede que sea quiral como puede que no.
Propiedades de los enantiómeros
La mayoría de sus propiedades físicas y químicas son idénticas
Al igual que la mano derecha y la mano izquierda, los enantiómeros solo vienen en pares. Estos compuestos son prácticamente idénticos entre sí. De hecho, la mayoría de sus propiedades físicas y químicas como el punto de fusión, de ebullición, presión de vapor y la solubilidad en algunos solventes, entre otras, son idénticas.
Actividad óptica
Todos los compuestos quirales tienen una propiedad única que los distingue de aquellos que no lo son: tienen la capacidad de hacer rotar el plano de la luz polarizada. Esta propiedad se denomina actividad óptica, y es una de las pocas propiedades que distingue a un compuesto quiral de su enantiómero.
Esto último se debe a que el plano de luz polarizada se puede rotar en una de dos direcciones, bien sea en el sentido de las agujas del reloj (denominado dextrógiro y representado con el símbolo +) o en contra de las agujas del reloj (levógiro, representado con el símbolo -).
Si un compuesto quiral gira el plano de luz polarizada en una dirección, su enantiómero la hará girar en la dirección contraria.
Ejemplo
Una solución de D-glucosa gira el plano de luz polarizada en el sentido de las agujas del reloj (hacia la derecha, es dextrógira), mientras que una solución de L-glucosa la hace rotar en sentido contrario.
Reactividad diferencial
Otra propiedad que permite distinguir a un enantiómero del otro, es su reactividad frente a otros compuestos quirales.
La reactividad diferencial se puede comparar con la forma como un guante solo le queda bien a una mano, pero no a la otra, o como un zapato derecho se ajusta bien al pie derecho, pero no al izquierdo.
Una consecuencia importante de la reactividad diferencial, son los distintos efectos que pueden causar los dos enantiómeros de algunos medicamentos. Estas diferencias pueden ser inofensivas, pero también pueden ser muy peligrosas.
Ejemplos
- De los dos enantiómeros del aspartame (que es un edulcorante artificial), uno es dulce mientras que el otro no tiene sabor.
- Solo el enantiómero S del omeprazol es efectivo como protector gástrico mientras que el otro no produce ningún efecto.
- La D-penicilamina es un medicamento contra la artritis reumatoide, mientras que su enantiómero, la L-penicilamina es un veneno peligroso.
Absorción diferencial
Los enantiómeros también difieren en la forma en que se absorben en resinas o sólidos que también son quirales. Una mezcla de enantiómeros se puede separar si se hace pasar por una columna de separación quiral, ya que uno de los dos enantiómeros se absorberá con más fuerza que el otro.
Nomenclatura de los enantiómeros
Existen varios métodos para identificar a uno u otro enantiómero, pero el más utilizado es el sistema Cahn-Ingold-Prelog (CIP). Éste consiste en los siguientes pasos:
- Se asigna un nivel de jerarquía a los cuatro grupos unidos a cada centro quiral. La prioridad de los grupos se asigna de acuerdo al número atómico del átomo directamente enlazado al centro quiral. Si hay dos átomos iguales, se procede a sumar los números atómicos de los átomos que estén enlazados a los primeros.
- Se determina la dirección en la que se recorren los tres grupos prioritarios cuando el de menor prioridad apunta hacia atrás.
- Si la dirección del recorrido es en el sentido de las manecillas del reloj, se le asigna la configuración R, de lo contrario se le asigna la configuración S.
Ejemplo

Ejemplos de enantiómeros
D-gliceraldehído y L-gliceraldehído

El gliceraldehído es el carbohidrato quiral más simple y pequeño que existe, y es muy importante tanto para la química como para la biología.
Según las reglas del sistema Cahn-Ingold-Prelog, el isómero D corresponde al isómero (R) y el isómero L corresponde al (S).
D-Alanina y L-Alanina

La alanina es uno de los aminoácidos esenciales para la construcción de las proteínas. Como casi todos los aminoácidos, posee un carbono quiral así que tiene dos enantiómeros:
De estos dos, la L-alanina es la más común y está presente en todos los seres vivos, mientras que la D-alanina solo está presente en algunas paredes celulares bacterianas.
Ácido D-tartárico y L-tartárico

La quiralidad fue descubierta por Louis Pasteur en 1848 gracias al ácido tartárico. Este compuesto posee 2 carbonos asimétricos y puede existir como dos enantiómeros más un tercer isómero que se denomina compuesto meso.
La configuración absoluta de los dos carbonos quirales son R para el enantiómero levógiro y S para el enantiómero dextrógiro.
2-butanol
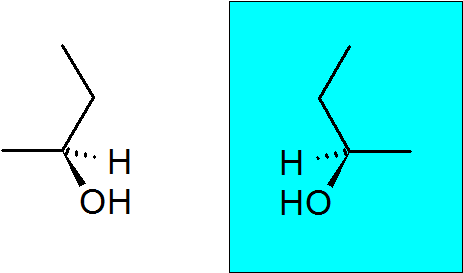
Este alcohol también posee un carbono quiral, lo que hace que este compuesto posea dos enantiómeros.
Bromocloroetano

Es un compuesto quiral muy simple con solo dos carbonos. El carbono quiral tiene unidos un bromo, un cloro, un metilo y un hidrógeno.
Referencias
- Chirality (Chemistry). (18 de Marzo de 2021), en Wikipedia.com
- Carey, F. A. (2008). Organic chemistry. Boston: McGraw-Hill Higher Education.
- Smith, M., March, J., & March, J. (2001). March’s advanced organic chemistry: Reactions, mechanisms, and structure. New York: Wiley.
- M.H. Hyun (2012). 8.13 Chromatographic Separations and Analysis: Chiral Crown Ether-Based Chiral Stationary Phases. Editor(s): Erick M. Carreira, Hisashi Yamamoto. Comprehensive Chirality. Elsevier. Pages 263-285. ISBN 9780080951683,
- Nguyen, L. A., He, H., & Pham-Huy, C. (2006). Chiral drugs: an overview. International journal of biomedical science: IJBS, 2(2), 85–100.
