Carbonato de potasio (K2CO3): estructura, propiedades, usos, obtención
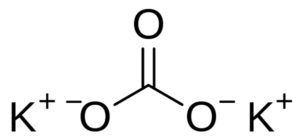
El carbonato de potasio es un compuesto inorgánico formado por dos iones potasio K+ y un ion carbonato CO32-. Su fórmula química es K2CO3. Se trata de un sólido blanco higroscópico, es decir, absorbe fácilmente el agua del ambiente. Por ello en los laboratorios se usa para absorber agua de otras sustancias.
Es muy soluble en agua formando soluciones alcalinas, las cuales son ricas en iones OH–y por lo tanto con un alto valor de pH. Sus soluciones acuosas, por ser alcalinas, se emplean en varios procesos industriales para absorber gases ácidos como el dióxido de carbono CO2 y el sulfuro de hidrógeno H2S, pues los neutraliza fácilmente.

El K2CO3 se emplea para preparar jabones, productos de limpieza, detergentes para lavar ropa y mezclas para lavar platos. También es utilizado en el procesamiento de algunas fibras textiles como la lana.
Es muy utilizado en laboratorios de química, por ejemplo para absorber agua de otros compuestos o para alcalinizar mezclas de reacciones químicas y también en análisis químicos.
Además se agrega a algunos alimentos, por ejemplo, para eliminar el sabor amargo de las semillas de cacao durante la producción del chocolate.
Índice del artículo
El carbonato de potasio está formado por dos cationes potasio K+ y un anión carbonato CO32-. El anión carbonato posee una estructura plana y simétrica, mientras los tres átomos de oxígeno rodean al carbono formando un triángulo plano.
– Carbonato de potasio
– Carbonato potásico
– Carbonato de dipotasio
– Potasa
– Sal de potasio del ácido carbónico.
Sólido cristalino incoloro a blanco.
138,205 g/mol.
899 ºC.
Se descompone.
2,29 g/cm3
Muy soluble en agua: 111 g/100 g de agua a 25 °C. Insoluble en etanol y en acetona.
Una solución acuosa puede tener un pH de 11,6, es decir, es bastante alcalina.
El carbonato de potasio es delicuescente o higroscópico, es decir, absorbe humedad del ambiente. Posee un hidrato estable, el K2CO3.2H2O.
El K2CO3 en solución acuosa se hidroliza, esto es, reacciona con el agua liberando grupos OH– los cuales son los que le dan alcalinidad a las soluciones:
CO32- + H2O ⇔ OH– + HCO3–
HCO3– + H2O ⇔ OH– + H2CO3
Se puede obtener de las cenizas que quedan al quemar plantas. También por carbonatación del hidróxido de potasio KOH, es decir, añadiendo exceso de dióxido de carbono CO2 al KOH:
KOH + CO2 → KHCO3
2 KHCO3 + calor → K2CO3 + H2O
Otra forma de obtenerlo es calentando el cloruro de potasio KCl con carbonato de magnesio MgCO3, agua y CO2 bajo presión. Se obtiene primero una sal doble hidratada de magnesio y potasio MgCO3.KHCO3.4H2O, denominada sal de Engels:
2 KCl + 3 MgCO3 + CO2 + 5 H2O → MgCO3.KHCO3.4H2O↓ + MgCl2
La sal doble hidratada de Engels precipita y se separa de la solución por filtración. Luego se calienta y se forma el carbonato de potasio K2CO3 que al añadir agua se disuelve mientras que el carbonato de magnesio MgCO3 permanece insoluble y se elimina por filtración.
MgCO3.KHCO3.4H2O + calor → MgCO3↓ + 2 K+ + CO32- + CO2↑ + 9 H2O
La solución de carbonato de potasio es el tratamiento clásico para la remoción de dióxido de carbono CO2 en diversos procesos, especialmente en aplicaciones de altas presiones y temperaturas.

La remoción de CO2 ocurre según la siguiente reacción:
K2CO3 + CO2 + H2O ⇔ 2 KHCO3
Este método se emplea por ejemplo para tratar gas natural. También en plantas de generación de energía, para evitar la emisión de CO2 a la atmósfera, y en la producción de hielo seco.

La solución de K2CO3 se puede regenerar térmicamente, esto es, por calentamiento a temperaturas alrededor de 100 °C.
Para que la solución de carbonato de potasio pueda absorber el CO2 a una buena velocidad se añaden promotores que aceleran el proceso como la dietanolamina (DEA).
Las soluciones de carbonato de potasio también se emplean para remover gas de sulfuro de hidrógeno H2S de corrientes de proceso. En ocasiones se añade trifosfato de potasio K3PO4 para acelerar el proceso.
El K2CO3 permite realizar síntesis orgánicas, por ejemplo, en reacciones de condensación y para neutralizar. Sirve para remover agua de líquidos orgánicos, como agente deshidratante o desecante en el laboratorio.
También se emplea en reacciones de química analítica y para alcalinizar en la industria farmacéutica.
El K2CO3 se emplea para fabricar jabón, fórmulas de limpieza, productos para lavado de ropa y lavado de platos y también para preparar champú y otros productos de cuidado personal.

El carbonato de potasio es añadido a diversos alimentos con varios propósitos.
Por ejemplo, se agrega a las semillas de cacao para eliminar su sabor amargo y utilizarlas en la producción de chocolate. Se añade a las uvas en el proceso de secado para obtener uvas pasas.

En pastelería se usa como leudante (que actúa de levadura) de la harina para preparar alimentos horneados.

El K2CO3 se emplea para fertilizar suelos ácidos, pues el ion carbonato CO32- en contacto con agua produce iones OH– que aumentan el pH del suelo. Además el potasio K+ es un nutriente para las plantas.
El carbonato de potasio también ha sido utilizado para fabricar fertilizantes de liberación lenta.
Un fertilizante de liberación lenta libera o suelta los nutrientes de forma pausada para que no sean disueltos y arrastrados por el agua. Gracias a ello, podrán pasar más tiempo disponible para las raíces de la planta.
El carbonato de potasio K2CO3 también se utiliza para:
– Procesos de tintorería, blanqueado y limpieza de lana cruda y otras actividades de la industria textil
– La obtención de otras sales de potasio orgánicas e inorgánicas, como cianuro de potasio KCN.
– Funcionar como regulador de la acidez en diversos procesos.
– Fabricar cerámica y alfarería.
– Procesos de grabado y litografía.
– Curtido y acabado de cueros.
– Preparar tintas para imprimir, pigmentos.
– Fabricar vidrios especialmente para la televisión, pues el K2CO3 es más compatible que el de carbonato de sodio Na2CO3 con los óxidos de plomo, bario y estroncio que contienen estos vidrios.
– El tratamiento de aguas.
– Retardar el fuego (en forma de soluciones acuosas).
– Inhibir la corrosión y como agente anti-incrustaciones en equipos de procesos.
- U.S. National Library of Medicine. (2019). Potassium carbonate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). The Chemistry of the Metallic Elements. Pergamon Press Ltd. London.
- Mokhatab, S. et al. (2019). Natural Gas Treating. The Potassium Carbonate Solution. In Handbook of Natural Gas Transmission and Processing (Fourth Edition). Recuperado de sciencedirect.com.
- Kakaras, E. et al. (2012). Pressurized fluidized bed combustion (PFBC) combined cycle systems. Pressurized fluidized bed combustion with carbon capture and storage. In Combined Cycle Systems for Near-Zero Emission Power Generation. Recuperado de sciencedirect.com.
- Speight, J.G. (2019). Hydrogen Production. Wet Scrubbing. In Heavy Oil Recovery and Upgrading. Recuperado de sciencedirect.com.
- Branan, C.R. (2005). Gas treating: Chapter updated by Chris Higman. Hot Carbonate Processes. In Rules of Thumb for Chemical Engineers (Fourth Edition). Recuperado de sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fourth Edition. John Wiley & Sons.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. VCH Verlagsgesellschaft mbH.
- Li, Y. and Cheng, F. (2016). Synthesis of a novel slow-release potassium fertilizer from modified Pidgeon magnesium slag by potassium carbonate. J Air Waste Manag Assoc, 2016 Aug; 66(8): 758-67. Recuperado de ncbi.nlm.nih.gov.
