Partículas subatómicas (concepto, significado y características)

¿Qué son las partículas subatómicas?
Las partículas subatómicas son más pequeñas que el átomo y se encuentran en la naturaleza, casi todas formando parte de él. Conocemos bien las principales y más estables, que son el electrón, el protón y el neutrón.
Toda la materia está compuesta de estas partículas, aunque existen otras, si bien durante mucho tiempo se ignoró su existencia. Los primeros modelos atómicos, que datan de unos pocos siglos antes de Cristo, suponían que los átomos eran indivisibles, algo así como canicas que al combinarse de cierta forma daban lugar a los distintos elementos.
Cuando se supo que no era así, gracias a los descubrimientos del electrón en el siglo XIX y el núcleo atómico a comienzos del siglo XX, los científicos se preguntaron si estas partículas tenían una estructura interna.
Resultó que sí, que tanto el protón como el neutrón son partículas compuestas por otras más pequeñas aún, que no tienen estructura interna: son las partículas elementales.
Por eso las partículas subatómicas se dividen en:
- Partículas compuestas.
- Partículas elementales.
Las partículas elementales son los quarks, los gluones y los leptones. Los quarks y los gluones conforman a los protones y a los neutrones, mientras que el electrón, una partícula elemental, es un leptón.
Descubrimiento de las partículas subatómicas
Los descubrimientos de las partículas subatómicas comenzaron a partir del siglo XIX y el primero en ser encontrado fue el electrón.
Hacia 1890, los físicos estaban muy ocupados estudiando la radiación y la transmisión de ondas electromagnéticas. J. J. Thomson era uno de ellos y realizó numerosos experimentos con un tubo al que se le había extraído el aire y puesto un par de electrodos.
Cuando se aplicaba un voltaje, se producían unos rayos misteriosos, llamados rayos catódicos, cuya naturaleza era desconocida, hasta que J. J. Thomson (1856-1940) descubrió que consistían en un chorro de partículas cargadas negativamente.
Thomson obtuvo el cociente entre la carga y la masa de estas partículas: 1.76 x 108 C/g, donde C significa culombio, la unidad para la carga eléctrica en el Sistema Internacional de Unidades y g es gramo.
Y encontró dos cosas muy importantes, la primera que la masa de las partículas era extremadamente pequeña, y segundo, que este valor era el mismo para todas ellas, sin importar de qué estuviesen hechos los electrodos.
El valor de la carga fue hallado poco después, a comienzos de la década de 1900, por el físico norteamericano Robert Millikan (1868-1953) y sus colaboradores, gracias al experimento de la gota de aceite.
El núcleo atómico: protones y neutrones
A finales del siglo XIX, Henri Becquerel (1852-1908) había descubierto el fenómeno de la radiactividad natural, lo que intrigó a otros físicos como los esposos Marie y Pierre Curie, así como al neozelandés Ernest Rutherford.
Este último encontró tres diferentes tipos de radiación provenientes de muestras de uranio, un conocido elemento radiactivo. Las nombró con las primeras tres letras del alfabeto griego: α, β, y γ.
Experimentos de dispersión de Rutherford

Usando las partículas α, muy energéticas y cargadas positivamente, Rutherford bombardeó delgadas láminas de oro y encontró que, como esperaba, la mayoría de las partículas α atravesó las láminas sin problema.
Pero curiosamente, una pequeña fracción de partículas era desviada y unas pocas inclusive rebotaron en sentido contrario. Esto último era inimaginable, pues tal como Rutherford afirmó, era como disparar con un rifle a un delgado pañuelo y ver que las balas se regresan.
La razón de que las partículas α se desvíen es que dentro de la lámina hay algo que las repele y por lo tanto debe estar cargado positivamente. Se trata del núcleo atómico, diminuto en tamaño, pero que contiene casi toda la masa del átomo.
El descubrimiento del neutrón
El neutrón tardó un poco más en ser encontrado y se debió al físico inglés James Chadwick (1891-1974), estudiante de Rutherford. El mismo Rutherford había propuesto la existencia de una partícula sin carga en el núcleo, para explicar por qué este no se desintegra a causa de la repulsión electrostática.
Los experimentos de Chadwick revelaron en 1932 la existencia de una partícula de masa muy semejante a la del protón, pero sin carga. Por eso la llamaron neutrón y junto al protón, son los componentes esenciales del núcleo atómico.
Las principales partículas subatómicas
En general, las partículas subatómicas se caracterizan por tener:
- Masa.
- Carga eléctrica.
- Espín.
El espín es una cualidad análoga a la rotación sobre el eje, pero de naturaleza enteramente cuántica. Y por otro lado, hay partículas con carga y masa 0, como el fotón.
Electrón
El electrón es una partícula subatómica estable, cargada negativamente y perteneciente al grupo de los leptones, siendo el de menor masa. Forma parte esencial del átomo, sin embargo puede existir aislado de este, en forma de electrones libres.
De hecho, es la carga eléctrica más pequeña que puede encontrarse en la naturaleza, por ello cualquier otra es múltiplo de la del electrón, de acuerdo al principio de cuantización de la carga.
Sus principales características son:
- Masa: 9.1 x 10-31 kg
- Carga: e = -1.6 x 10-19 C
- Espín: ± ½
- Antipartícula: positrón.
El electrón es responsable de la formación de enlaces químicos, así como en la conducción eléctrica y térmica. Y gracias a la mecánica cuántica, sabemos que el electrón tiene un comportamiento dual: de onda y partícula a la vez.
Protón
Es una partícula cargada eléctricamente, cuya carga es la misma en magnitud que la del electrón, pero de signo contrario.
El protón no es una partícula elemental como el electrón, sino que está compuesto por tres quarks unidos por gluones y es mucho más masivo que el electrón.
A diferencia de este, el protón se encuentra confinado al núcleo atómico, y su cantidad determina de qué elemento se trata, así como sus propiedades.
- Masa: 1.672 x 10-27 kg
- Carga: e = +1.6 x 10-19 C
- Espín: ½
- Antipartícula: antiprotón.
Neutrón
El neutrón junto al protón conforma el núcleo atómico y también se compone de tres quarks: dos del tipo down y uno de tipo up.
- Masa: 1.675 x 10-27 kg
- Sin carga neta.
- Espín: ½.
Es una partícula estable dentro del núcleo atómico, pero como partícula libre decae con semivida de unos 10.3 minutos aproximadamente. Su masa es apenas mayor que la del protón y como hemos dicho, carece de carga neta.
El número de neutrones de un átomo es importante, porque si bien no determina la naturaleza del elemento, como lo hace el protón, sí determina la clase de isótopo.
Los isótopos de un elemento son variantes del mismo y su comportamiento puede ser bastante diferente entre sí. Los hay estables e inestables, por ejemplo el hidrógeno tiene como isótopos el deuterio y el tritio.
Bombardeando con neutrones a los átomos de ciertos compuestos de uranio y plutonio, el núcleo se fisiona y descompone en partículas. La reacción nuclear en cadena que se produce es capaz de emitir gran cantidad de energía.
Quarks
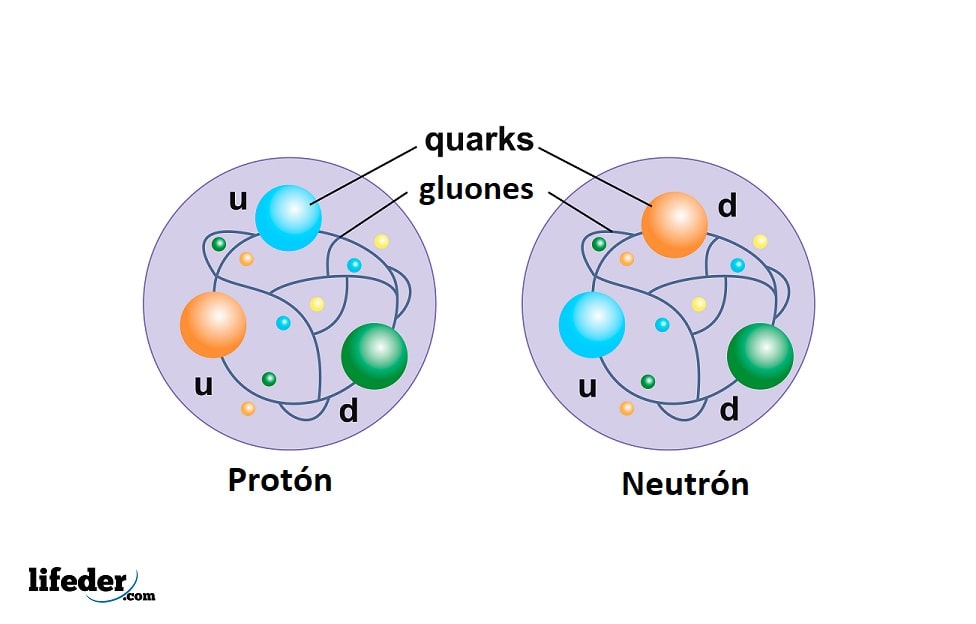
Son los constituyentes de los protones y neutrones. Hasta ahora se han encontrado 6 tipos de quarks, pero ninguno como partícula libre, sino asociados para formar otras partículas compuestas.
La evidencia de su existencia se obtuvo mediante experimentos realizados desde los años 60, con el acelerador lineal de Stanford y después en el CERN.
- Carga: +2/3e, -1/3e
- Espín: ½
- Antipartícula: antiquark.
Otras partículas
A partir de 1930 se sucedieron los descubrimientos de nuevas partículas, muchas predichas por la teoría. El modelo estándar de partículas contempla la existencia de 17 tipos de partículas fundamentales, entre quarks, leptones, bosones y el bosón de Higgs.
Además tienen sus respectivas antipartículas, que al interaccionar se aniquilan, generando nuevas partículas. A continuación mencionamos algunas de ellas:
-Positrón, idéntico al electrón pero con carga positiva.
-Neutrino, sin carga.
-Mesón.
-Bosones, que son los portadores de las interacciones fundamentales, excepto la gravedad.
-El bosón de Higgs, responsable de la masa.
-Gravitón, es una partícula propuesta para explicar la gravedad, pero aún no hay evidencia de que exista.
Referencias
- Chang, R. 2013. Química. 11va. Edición. Mc Graw Hill Educación.
- Cobian, J. El modelo estándar de partículas. Recuperado de: sne.es.
- Fernández de Sala, P. Partículas elementales, partículas compuestas y partículas virtuales. Recuperado de: ific.uv.es.
- Giambattista, A. 2010. Physics. 2nd. Ed. McGraw Hill.
- Olmo, M. Protones y neutrones. Recuperado de: hyperphysics.phy-astr.gsu.edu.
