Integrinas: características, estructura y funciones
Las integrinas son un gran grupo o familia de proteínas de la superficie celular, aparentemente exclusivas del reino animal. Son el principal recurso de las células para mantener la interacción (en forma de adhesión) con otras células y con la matriz celular.
Su estructura está conformada por dos subunidades llamadas alfa y beta. En mamíferos se sabe que existen entre 16-18 unidades alfa y 3-8 betas, las cuales van a actuar dependiendo de su combinación, y también del estado fisiológico de la célula o tejido específico.
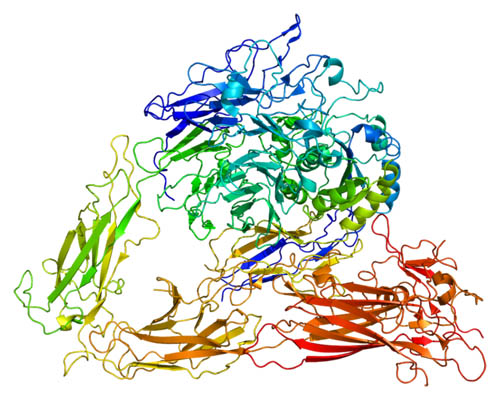
Existen varias proteínas que tienen funciones adhesivas. Sin embargo, el grupo de las integrinas es el que está más distribuido e interacciona con todas las proteínas claves de la matriz celular. Las integrinas participan en la fagocitosis, migración celular, y curación de heridas, e incluso son muy estudiadas por su participación en la metástasis.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Las integrinas y el cáncer
- 5 Perspectiva evolutiva
- 6 Referencias
Son proteínas que se caracterizan por unir de forma mecánica el citoesqueleto celular de una célula a otra y/o a la matriz extracelular (en una interacción célula-célula y/o célula-matriz). Bioquímicamente detectan si se ha realizado o no la adhesión, y transducen señales celulares vinculando el entorno extracelular con el intracelular, en ambos sentidos.
Trabajan o funcionan con otros receptores tales como inmunoglobilinas, cadherina, selectinas y sindecandos. Con respecto los ligandos de las integrinas, estos están constituidos por fibronectina, fibrinógeno, colágeno y vitronectina, entre otros.
La unión de estas a sus ligandos se debe a cationes divalentes extracelulares como el calcio o magnesio. El uso de uno u otro dependerá de la integrina específica.
Las integrinas tienen una forma alargada terminada en una cabeza en forma de globo, que según observaciones de microscopia electrónica, se proyecta a más de 20 nanómetros de la bicapa lipídica.
Las integrinas son heterodímeros, es decir, que son moléculas conformadas siempre por dos proteínas. Ambas proteínas son consideradas subunidades o protómeros y se les diferencia como subunidad alfa y subunidad beta. Ambas subunidades están unidas de forma no covalente. Presentan una masa molecular de entre 90 a 160 kDa.
El número de subunidades alfa y beta varía entre los distintos grupos de organismos en el reino animal. En insectos como la mosca de la fruta (Drosophyla), por ejemplo, hay 5 subunidades alfa y 2 beta, mientras que en gusanos nematodos del género Caenorhabditis hay2 alfas y una beta.
En mamíferos, los investigadores sugieren que existe un número fijo de subunidades y de combinaciones de estas; sin embargo, en la bibliografía no existe consenso en cuanto a este número. Por ejemplo, algunos mencionan que existen 18 subunidades alfa, 8 beta y 24 combinaciones, mientras que otros hablan de 16 alfa y 8 beta para 22 combinaciones.
Cada subunidad presenta la siguiente estructura.
La subunidad alfa presenta una estructura con un dominio de hélice β de siete hojas o láminas que forman la cabeza, un dominio en el muslo, dos dominios de la pantorrilla, un solo dominio transmembrana y además una corta cola citoplasmática que no presenta actividad enzimática o de unión a actina.
Presenta cadenas con unos 1000 a 1200 residuos. Puede unir cationes bivalentes.
En mamíferos, que es en donde más se han estudiado las integrinas, las subunidad alfa pueden agruparse según contenga o no un dominio insertado (alfa I).
Con dominio insertado Alfa I
El dominio insertado alfa I consiste en una región de 200 aminoácidos. La presencia de este dominio en las integrinas, indica que son receptores de colágeno y leucocitos.
Sin dominio insertado
Las integrinas alfa que no presentan el dominio integrado son clasificadas en 4 subfamilias, que veremos a continuación.
PS1
Los receptores de glucoproteína, también llamados lamininas, son vitales para integrar tejidos musculares, del riñón y la piel.
PS2
Esta subfamilia es la receptora del ácido arginilglicilaspártico, también conocido como RGD o Arg-Gly-Asp.
PS3
Esta subfamilia ha sido observada en invertebrados, particularmente en insectos. Aunque es poco lo que se sabe de ella, existen estudios que evalúan su papel esencial en la actividad funcional del gen de la integrina leucocitaria CD11d, en humanos.
PS4
Esta subfamilia es conocido como el grupo alfa 4 / alfa 9 y comprende las subunidades con esos mismos nombres.
Dichas subunidades son capaces de emparejarse con las subunidades beta 1 y beta 7. También, comparten ligandos muy parecidos a las subunidades alfa que presentan el dominio insertado alfa I, como las moléculas de adhesión celular vascular, ligandos solubles en sangre, fibrinógeno y otros, incluyendo incluso agentes patógenos.
Estructuralmente la subunidad beta consta de una cabeza, una sección llamada tallo / pierna, un dominio transmembrana y una cola citoplásmica. La cabeza está compuesta por un dominio beta I, que se inserta en un dominio híbrido que se une al dominio plexina-semáfora-integrina, también conocido como PSI.
La sección del tallo / pierna contiene cuatro módulos iguales o muy similares al factor de crecimiento epidérmico de la integrina rica en cisteína y, como ya fue mencionado, una cola citoplasmática. Esta cola citoplasmática, al igual que en la subunidad alfa, no tiene actividad enzimática ni de unión actina.
Presentan cadenas con un número de residuos que oscilan entre 760 y 790, y pueden unir, al igual que las subunidades alfa, cationes bivalentes.
Las integrinas tienen múltiples funciones, sin embargo por las que son principalmente conocidas son las que veremos a continuación.
La conexión que existe entre la célula y la matriz extracelular gracias a las integrinas favorece la resistencia de la célula al empuje mecánico, evitando que estas sean arrancadas de la matriz.
Varios estudios sugieren que el acoplamiento a la matriz celular es un requerimiento básico para el desarrollo de los organismos eucariotas pluricelulares.
La migración celular es un proceso en el que intervienen las integrinas mediante la unión o acoplamiento a distintos sustratos. Gracias a esto intervienen en la respuesta inmune y la cicatrización de heridas.
Las integrinas participan en el proceso de transducción de señales. Esto significa que intervienen en la recepción de información proveniente del fluido extracelular, la codifican y luego comienza la alteración de moléculas intracelulares, a manera de respuesta.
Esta transducción de señales interviene en una gran cantidad de procesos fisiológicos como la destrucción celular programada, diferenciación celular, meiosis y mitosis (división celular), y crecimiento celular, entre otros.
Varios estudios demuestran que las integrinas juegan un papel importante en el desarrollo de tumores, especialmente en la metástasis y la angiogénesis. Un ejemplo de esto son las integrinas αVβ3 y α1β1, entre algunas otras.
Estas integrinas han sido relacionadas con el crecimiento canceroso, con el aumento de la resistencia terapéutica y con las neoplasias hematopoyéticas.
Una adherencia eficiente entre las células para formar tejidos fue, sin lugar a dudas, una característica crucial que debió estar presente en el devenir evolutivo de los organismos multicelulares.
El surgimiento de la familia de las integrinas se ha rastreado hasta la aparición de los metazoos hace unos 600 millones de años.
Un grupo de animales con características histológicas ancestrales son los poríferos, comúnmente llamados esponjas de mar. En estos animales, la adhesión celular ocurre por una matriz extracelular de proteoglicano. Los receptores que se unen a esta matriz poseen un motivo típico de unión a integrina.
De hecho, en este grupo animal se han logrado identificar los genes relacionados con subunidades específicas de algunas integrinas.
En el curso de la evolución, el ancestro de los metazoos adquirió una integrina y un dominio de unión a esta que se ha conservado a través del tiempo en este inmenso grupo animal.
Estructuralmente, la complejidad máxima de las integrinas la vemos en el grupo de los vertebrados. Existen distintas integrinas que no están presentes en los invertebrados, con nuevos dominios. Efectivamente, en el humano se han identificado más de 24 integrinas funcionales diferentes – mientras que en la mosca de la fruta Drosophila melanogaster existen solo 5.
- Integrina. Clínica Universidad de Navarra. Recuperado de cun.es.
- Adhesión. Atlas de histología vegetal y animal. Recuperado de mmegias.webs.uvigo.es.
- B. Alberts, A. Johnson, J. Lewis, et al. (2002). Molecular Biology of the Cell. 4th edition. New York: Garland Science. Integrins. Recuperado de ncbi.nlm.nih.gov.
- R.L. Anderson, T.W. Owens & J. Matthew (2014). Structural and mechanical functions of integrins. Biophysical Reviews.
- Integrin. Recuperado de en.wikipedia.org.
- What is integrin? MBINFO. Recuperado de mechanobio.info.
- S. Mac Fhearraigh & D. Bruce. The role of integrins in cell signaling. Recuperado de abcam.com.
- A.S. Berghoff, O. Rajky, F. Winkler, R. Bartsch, J. Furtner, J.A Hainfellner, S.L. Goodman, M. Weller, J. Schittenhelm, M. Preusser (2013). Invasion patterns in brain metastases of solid cancers. Neuro Oncology.
