Espectro de absorción: qué es, absorción atómica, espectro visible
¿Qué es un espectro de absorción?
Un espectro de absorción es el producto de la interacción de la luz con un material o sustancia en cualquiera de sus estados físicos. La interacción comprende un amplio segmento del abanico de las longitudes de onda y energía de la radiación electromagnética.
En otras palabras, el espectro de absorción refleja esa fracción de la radiación electromagnética que un determinado material absorbe en un rango de frecuencias.
En este sentido, algunos sólidos, líquidos o gases pueden absorber fotones de diferentes energías o longitudes de onda, desde la radiación ultravioleta, seguidos de la luz visible, hasta la radiación o luz infrarroja, escalonando en las longitudes de onda de los microondas.
El ojo humano percibe solamente las interacciones de la materia con la luz visible. Asimismo, es capaz de contemplar la difracción de la luz blanca a través de un prisma o un medio en sus componentes coloridos (imagen superior).
Si se “atrapara” el rayo de luz después de haber viajado a través de un material, y se analizara, se encontraría la ausencia de ciertas bandas de colores. Es decir, se observarían unas franjas negras contrastando con su fondo.
Este es el espectro de absorción, y su análisis es fundamental en la química analítica instrumental y la astronomía.
Absorción atómica
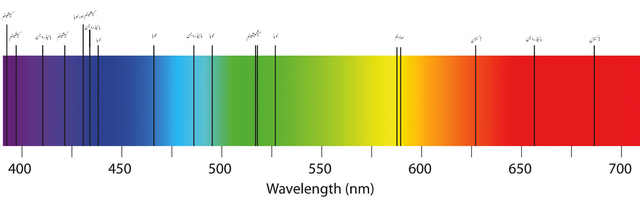
En la imagen superior se muestra un espectro de absorción típico de los elementos o átomos. Nótese que las franjas negras representan las longitudes de onda absorbidas, mientras que las otras son las emitidas. Esto significa que, por el contrario, un espectro de emisión atómica luciría como una banda negra con franjas de colores emitidos.
Pero, ¿qué son esas franjas? ¿Cómo saber si los átomos absorben o emiten (sin introducir la fluorescencia o fosforescencia)? Las respuestas están en los estados electrónicos permitidos de los átomos.
Transiciones y energías electrónicas
Los electrones son capaces de alejarse del núcleo, dejándolo cargado positivamente mientras transitan de un orbital de menor energía a uno de mayor energía. Para ello, explicado por la física cuántica, absorben fotones de una energía específica para realizar dicha transición electrónica.
Por lo tanto, la energía está cuantizada, y no absorberán medio o tres cuartas partes de un fotón, sino valores de frecuencia (ν) o longitudes de onda (λ) concretos.
Una vez excitado el electrón, este no permanece por tiempo ilimitado en el estado electrónico de mayor energía. Libera la energía en forma de un fotón, y el átomo vuelve a su estado basal u original.
Dependiendo de si se registran los fotones absorbidos, se tendrá un espectro de absorción. Y si se registran los fotones emitidos, entonces el resultado será un espectro de emisión.
Este fenómeno puede observarse experimentalmente si se calientan muestras gaseosas o atomizadas de un elemento. En la astronomía, comparando dichos espectros puede conocerse la composición de una estrella, e incluso, su ubicación relativa a la Tierra.
Espectro visible
Como puede apreciarse en la imagen, el espectro visible comprende los colores desde el violeta hasta el rojo y todas sus tonalidades respecto a cuánto absorbe el material (matices oscuros).
Las longitudes de onda de la luz roja corresponden a valores de 650 nm en adelante (hasta desaparecer en la radiación infrarroja).
Y por el extremo izquierdo, el violeta y los tonos morados cubren los valores de longitudes de onda hasta los 450 nm. El espectro visible entonces abarca desde los 400 hasta los 700 nm aproximadamente.
A medida que aumenta λ, disminuye la frecuencia del fotón, y, por tanto, su energía. Siendo así, la luz violeta tiene mayor energía (menores longitudes de onda) que la luz roja (mayores longitudes de onda).
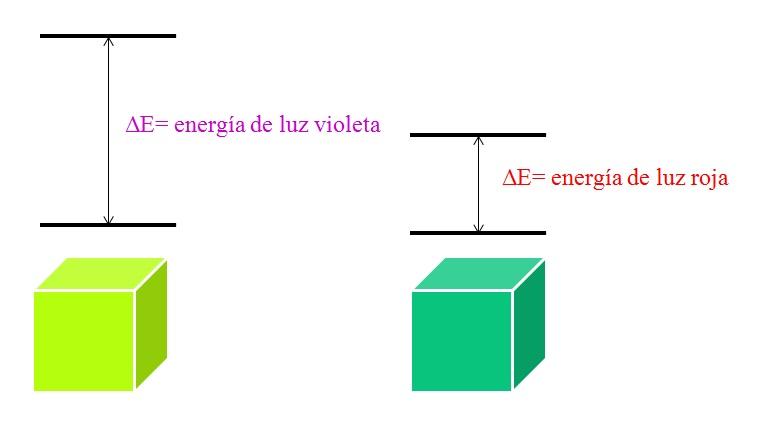
Por eso, un material que absorba la luz morada implica transiciones electrónicas de mayores energías.
Cuando el material absorbe el color violeta, lucirá un color amarillo verdoso, lo cual significa que sus electrones realizan transiciones muy energéticas. Y cuando el material absorbe el color rojo, de menor energía, reflejará un color verde azulado.
Cuando un átomo es muy estable, por lo general presenta estados electrónicos muy distantes en energía, y así necesitará absorber fotones de mayor energía para permitir las transiciones electrónicas:
Espectro de absorción de las moléculas
Las moléculas tienen átomos, y estos absorben también la radiación electromagnética. Sin embargo, sus electrones forman parte del enlace químico, por lo que sus transiciones son diferentes. Uno de los grandes triunfos de la teoría del orbital molecular es el poder relacionar los espectros de absorción con la estructura química.
Así, los enlaces simples, dobles, triples, conjugados, y las estructuras aromáticas, poseen sus propios estados electrónicos, absorbiendo fotones muy específicos.
Al poseer varios átomos, además de las interacciones intermoleculares y las vibraciones de sus enlaces (que también absorben energía), los espectros de absorción de las moléculas tienen forma de “montañas”, las cuales indican las bandas que comprenden las longitudes de onda donde ocurren las transiciones electrónicas.
Gracias a estos espectros puede caracterizarse un compuesto, identificarlo, e incluso, mediante análisis multivariantes, cuantificarlo.
Azul de metileno
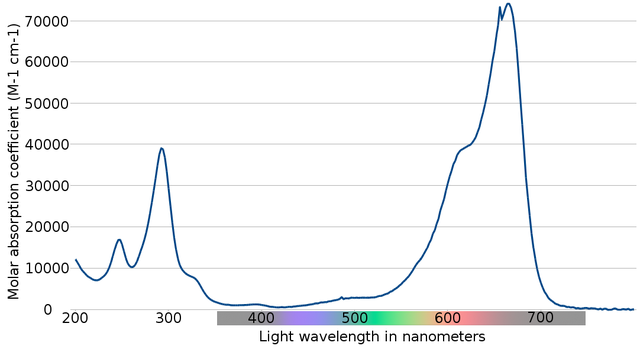
En la imagen superior se muestra el espectro del indicador azul de metileno. Como su nombre señala, es de color azul, pero, ¿puede comprobarse con su espectro de absorción?
Nótese que hay bandas entre las longitudes de onda de 200 y 300 nm. Entre 400 y 500 nm casi no hay absorción, es decir, no absorbe los colores violeta, azul ni verde.
No obstante, presenta una intensa banda de absorción después de los 600 nm, y, por lo tanto, posee transiciones electrónicas de baja energía que absorben fotones de luz roja.
En consecuencia, y dados los altos valores de las absortividades molares, el azul de metileno exhibe un intenso color azul.
Clorofilas a y b
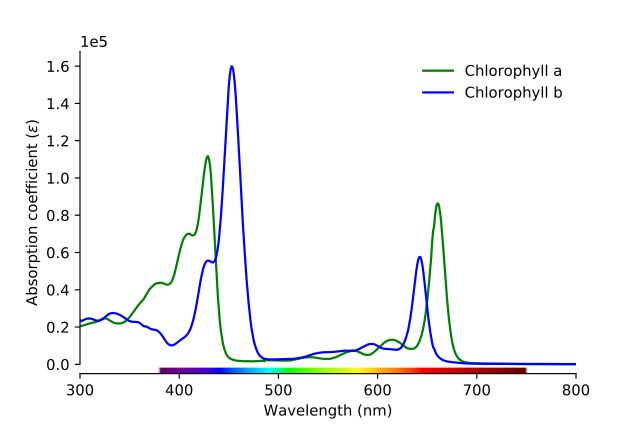
Como se aprecia en la imagen, la línea verde corresponde al espectro de absorción de la clorofila a, mientras que la línea azul corresponde a la de la clorofila b.
Primeramente, deben compararse las bandas donde las absortividades molares son mayores, en este caso, las que se hallan a la izquierda, entre los 400 y 500 nm. La clorofila a absorbe intensamente los colores morados, mientras que la clorofila b (línea azul) lo hace con el color azul.
Al absorber la clorofila b alrededor de los 460 nm (el azul), se refleja el color amarillo. Por otro lado, absorbe también intensamente, cerca de los 650 nm, la luz anaranjada, lo cual significa que exhibe el color azul. Si el amarillo y el azul se mezclan, da como resultado el color verde.
Y para finalizar, la clorofila a absorbe el color violeta azulado, y además, una luz roja cerca de los 660 nm. Por lo tanto, exhibe un color verde “suavizado” por el amarillo.
Referencias
- Observatoire de Paris (s.f.). Las diferentes clases de espectros. Recuperado de media4.obspm.fr
- Campus Universitario de Rabanales (s.f.). Espectrofometría: Espectros de absorción y cuantificación colorimétrica de biomoléculas. Recuperado de uco.es
