¿Qué son las triadas de Döbereiner?
Las triadas de Döbereiner son grupos de tres elementos químicos que comparten características similares. Forman parte de los 118 elementos químicos, siendo la diversidad de reacciones mostradas y sus compuestos, su aspecto más fascinante.
La idea de clasificar los elementos es tratar adecuadamente sus propiedades químicas sin necesidad de desarrollar aisladamente un conjunto de reglas y teorías para cada uno de ellos.
Su clasificación periódica ha dado un marco sistemático inmensamente útil para correlacionarlos de acuerdo a unos pocos patrones muy simples y lógicos.
Los elementos están sistemáticamente dispuestos en filas y columnas con números atómicos cada vez mayores, y se ha reservado espacio para nuevos descubrimientos.
En 1815 solo eran conocidos alrededor de 30 elementos. Aunque había mucha información disponible sobre estos y sus compuestos, no había orden aparente.
Se hicieron varios intentos para encontrar el orden, sin embargo, resultaba difícil organizar todo lo que se sabía, por lo que numerosos científicos comenzaron a buscar algún patrón en sus propiedades que permitiera remediar esta situación.
Descubrimiento de las triadas de Döbereiner
El científico Johann Wolfgang Döbereiner realizó importantes hallazgos sobre la regularidad numérica entre los pesos atómicos de los elementos, fue el primero en notar la existencia de varios grupos de tres elementos, a los que llamó triadas, que mostraban similitudes químicas.
Dichos elementos revelaban una relación numérica importante, ya que una vez ordenados según su peso equivalente, o peso atómico, el peso del elemento central resultaba ser la media aproximada de los dos elementos restantes en la triada.
En 1817 Döbereiner encontró que si ciertos elementos se combinaban con el oxígeno en compuestos binarios, se podría discernir una relación numérica entre los pesos equivalentes de estos compuestos.
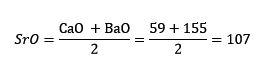
La observación de Döbereiner tuvo al principio poco impacto en el mundo químico, pero luego se hizo muy influyente. En la actualidad se le considera como uno de los pioneros del desarrollo del sistema periódico.
Doce años después, en 1829, Döbereiner añadió tres nuevas triadas, las cuales se muestran a continuación:
Grupo halógeno
El cloro, el bromo y el yodo presentan propiedades químicas similares y forman una triada. Estos elementos son no metales muy reactivos. Si se enumeran en orden de masa relativa creciente están en orden de reactividad decreciente. El Bromo tiene masa atómica intermedia entre el cloro y el yodo.

La masa atómica del elemento medio Bromo (Br) es igual al promedio de las masas atómicas de Cloro (Cl) y Yodo (I).
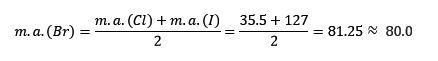
El valor promedio obtenido es cercano a la masa atómica del Bromo (Br).
Similitudes en propiedades químicas:
- Son todos no metales.
- Todos ellos reaccionan con agua para formar ácidos (por ejemplo, en: HCl, HBr, HF).
- Todos tienen una valencia de uno (por ejemplo, en: HCl, HBr, HF).
- Todos ellos reaccionan con metales alcalinos para formar sales neutras (por ejemplo, NaCl, NaBr, NaI)
Grupo metales alcalino
El litio, el sodio y el potasio tienen propiedades químicas similares y forman una triada. Estos elementos son metales suaves y ligeros pero muy reactivos.
Si se enumeran en orden de masa atómica relativa creciente, también están en orden de reactividad creciente. El sodio tiene la masa atómica intermedia entre el litio y el potasio.

La masa atómica del elemento central Sodio (Na) es igual al promedio de la masa atómica del Litio (Li) y el Potasio (K).
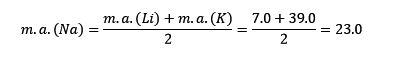
Similitudes en propiedades químicas:
- Son todos metales.
- Todos reaccionan con agua para formar soluciones alcalinas y gas hidrógeno.
- Todos tienen una valencia de uno (por ejemplo, en: LiCl, NaCl, KCl).
- Sus carbonatos son resistentes a la descomposición térmica.
Grupo de los calcógenos o anfígenos
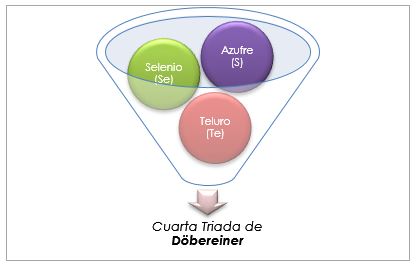
El azufre, el selenio y el teluro presentan propiedades químicas similares y forman una triada. El selenio tiene la masa atómica intermedia entre el azufre y el teluro.

La masa atómica del elemento medio Selenio (Se) es igual al promedio de masas atómicas de Azufre (S) y Teluro (Te).
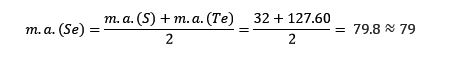
Una vez más el valor promedio obtenido es cercano a la masa atómica del Selenio (Se).
Similitudes en propiedades químicas:
- Las combinaciones con hidrógenos de estos elementos dan como resultado gases tóxicos.
- Cada uno de estos elementos tiene 6 electrones de valencia.
- Las cualidades metálicas aumentan a medida que aumenta el número atómico.
Döbereiner también advirtió que para ser válidas las triadas debían de revelar relaciones químicas entre los elementos así como relaciones numéricas.
Por otra parte se negó a agrupar el flúor junto con el cloro, el bromo y el yodo, como pudo haber hecho por razones químicas, porque no encontró una relación triádica entre los pesos atómicos del flúor y el de estos otros halógenos.
También se mostró renuente a considerar la aparición de tríadas entre elementos disímiles, como el nitrógeno, el carbono y el oxígeno, a pesar de que mostraban una relación numérica triádica significativa.
El trabajo de Dobereiner se centró en las relaciones entre los elementos de una triada, pero no dio ninguna pista sobre la relación entre las triadas.
Basta decir que la investigación de Döbereiner estableció la noción de triadas como un concepto poderoso, que varios otros químicos pronto tomarían en consideración.
De hecho, las triadas de Döbereiner, representaron el primer paso para agrupar los elementos en columnas verticales dentro de la tabla periódica y de esta manera establecer un sistema que explica las propiedades químicas y revela las relaciones físicas de los elementos.
Ampliación de las triadas
Otros químicos extendieron las triadas de Döbereiner para que incluyeran más de los tres elementos originales. Por ejemplo, se añadió flúor a la parte superior de la tríada que contenía cloro, bromo y yodo.
Se produjeron otras “triadas”, tales como una que contenía oxígeno, azufre, selenio y telurio. Pero no había ningún sistema que las correlacionara como un todo.
Uno de los principales inconvenientes era que muchas masas atómicas relativas todavía estaban equivocadas para la época.
Referencias
- Clugston, M. y Flemming, R. (2000).Advanced Chemistry. Nueva York, Oxford University Press.
- Johann Wolfgang Döbereiner. Recuperado de: britannica.com.
- Sauders, N. (2010). Breakthroughs in Science and Technology: Who Invented the Periodic Table?. Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007).The Periodic Table: Its Story and Its Significance. Nueva York, Oxford University Press.
- Shyamal, A. (2008).Living Science Chemistry 10. Nueva Delhi, Ratna Sagar P. Ltd.
- What is group 16 of the periodic table? How are those elements used? Recuperado de: quora.com.
