Medio SIM: fundamento, preparación y usos
El medio SIM es un agar semisólido y diferencial, especialmente diseñado para ayudar a la identificación de algunas bacterias, principalmente de la familia Enterobacteriaceae. Está compuesto por tripteína, peptona, sulfato de hierro, sulfato de amonio, tiosulfato de sodio y agar.
Este medio permite la ejecución de tres importantes pruebas: la producción de sulfuro de hidrógeno (H2S), la formación de indol y la motilidad, de allí proviene el acrónimo SIM. Por su gran utilidad no puede faltar en un laboratorio de bacteriología.

A diferencia de otros medios, este debe ser semisólido para que sea detectable la capacidad de movimiento que poseen algunas bacterias. En este sentido, esta prueba funciona muy bien para enterobacterias, no así en bacilos Gram negativos no fermentadores, en donde se prefiere usar otros métodos, como por ejemplo la gota pendiente.
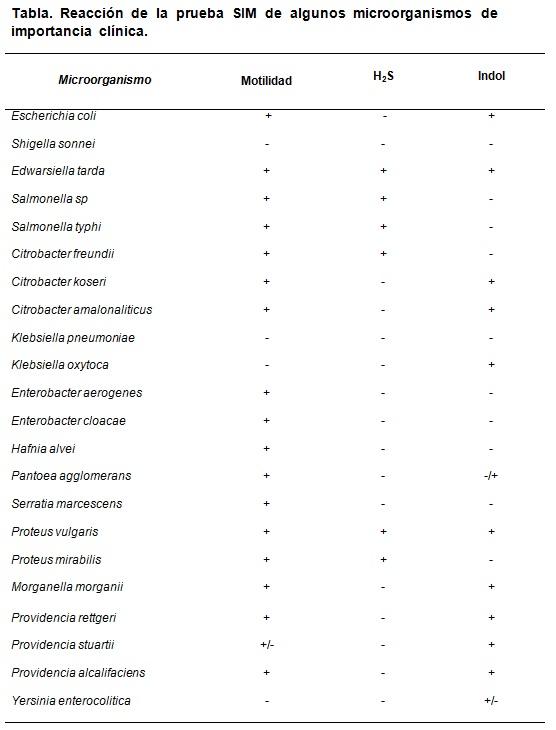
El medio SIM permite distinguir ciertas propiedades específicas que caracterizan a algunas bacterias en relación a otras. Por ejemplo Escherichia coli se distingue por ser H2S (-), Indol (+) y motilidad (+), mientras que Proteus mirabilis es H2S (+), indol (-), motilidad (+).
Índice del artículo
Es un medio de cultivo que se considera diferencial, debido a que su uso logra distinguir entre los microorganismos capaces de producir sulfuro de hidrógeno de los que no lo hacen; también destaca aquellas que forman indol a partir del triptófano de las que no lo forman, y finalmente diferencia las bacterias mótiles de las inmóviles.
Como todo medio de cultivo, posee elementos que brindan los nutrientes necesarios para que puedan desarrollarse los microorganismos no exigentes. Estos elementos están representados por las peptonas y la tripteína.
El desarrollo del microorganismo en el medio es esencial para poder observar la presencia o ausencia de las características que evalúa este medio.
La letra S del acrónimo SIM hace referencia a la producción de sulfuro de hidrógeno (H2S). Las bacterias capaces de formar sulfuro de hidrógeno tomarán el azufre del tiosulfato de sodio.
Una vez formado el H2S -gas incoloro-, este reacciona con la sal de hierro presente en el medio, formando sulfuro ferroso, claramente visible (precipitado negro). Las bacterias que no forman H2S, dejan el medio del color original (beige).
La presencia del precipitado negro, puede obstaculizar la interpretación de la motilidad. Sin embargo, se sabe que la mayoría de las enterobacterias productoras de H2S son motilidad positiva, tales como Salmonella, Proteus y Citrobacter. Además, el precipitado negro que abarca casi la totalidad del medio, sugiere motilidad positiva.
La segunda letra del acrónimo SIM es la “I”, la cual representa la formación de indol.
En este sentido, la tripteína, además de ser una fuente de nutriente, cumple otra función fundamental. Esta peptona es rica en un aminoácido llamado triptófano, por tanto, puede evidenciar a las bacterias que producen triptofanasa.
Esta enzima es la encargada de clivar al aminoácido triptófano, con la consecuente formación de indol (sustancia incolora), ácido pirúvico y amonio.
Es por ello que, para evidenciar esta reacción es necesario agregar una sustancia reveladora (reactivo de Ehrlich o reactivo de Kovac´s). Cualquiera de los dos reacciona con el indol, formando una sustancia de color rojo-fucsia en forma de anillo en la superficie del agar. Si el anillo color fucsia aparece la prueba de indol se interpreta como positiva.
Las bacterias que no posean esta enzima, no formarán el anillo y se interpreta como una prueba de indol negativa.
Es importante destacar, que la prueba del indol debe ser la última en interpretarse, ya que una vez agregado el reactivo, el medio se enturbia dificultando la visualización de la motilidad.
Por último la letra “M” de la palabra SIM significa motilidad. A fin de poder evaluar la motilidad, este medio es estratégicamente semi-sólido, pues esta característica es esencial para poder observar si existe o no movimiento bacteriano. Las bacterias que poseen flagelos son las que dan esta prueba positiva.
Una prueba positiva se pondrá en evidencia cuando se observe turbidez, tanto en el inóculo inicial, como alrededor de este. En tanto que, las bacterias no móviles solo se desarrollan en el trayecto del inóculo inicial.
Pesar 30 gr del medio deshidratado y disolver en un litro de agua destilada. La mezcla se deja en reposo por 5 minutos y luego se calienta hasta hervir, agitando frecuentemente hasta su completa disolución.
Distribuir la mezcla en tubos de ensayo con tapa de algodón y autoclavar a 121°C por 15 minutos. Sacar la gradilla de tubos del autoclave y dejar solidificar en posición vertical, para que el medio quede en forma de taco.
Para su conservación se guarda en nevera hasta su uso. El medio preparado debe tener un pH final de 7,3 ± 0,2.
Al momento de inocular el medio este debe estar a temperatura ambiente. El color del medio es beige.
Medir 150 ml de alcohol amílico o isoamílico o butílico. (Usar uno de los tres mencionados).
Disolver 10 gr de p-dimetilaminobenzaldehído. Luego, agregar lentamente 50 ml de ácido clorhídrico concentrado.
El reactivo listo para su uso es incoloro o amarillo claro. Debe conservarse en frasco ámbar y guardarse en nevera. No usar si toma un color castaño oscuro; eso indica que está dañado. Este reactivo se prefiere cuando se trata de enterobacterias.
Pesar 2 gr de p-dimetilaminobenzaldehido y disolver en 190 ml de alcohol etílico absoluto y mezclar lentamente con 40 ml de ácido clorhídrico concentrado. Conservar de igual manera al reactivo de Kovac´s. El reactivo de Ehrlich se usa mas para bacterias no fermentadoras y anaerobios.
El medio SIM es altamente utilizado en los laboratorios de bacteriología. Tiene como ventaja que en un mismo tubo pueden observarse tres características esenciales en la identificación de las enterobacterias.
El modo correcto de sembrar este medio es usando la aguja, con la cual se toma una porción de la colonia pura a estudiar y se inserta en el centro del medio en forma vertical. Se debe realizar una sola estocada. La punción no debe llegar hasta el fondo del tubo, lo correcto es abarcar solo las dos terceras partes de profundidad.
No es recomendable repetir el inóculo, ya que esto puede acarrear falsas interpretaciones de motilidad positiva. El medio inoculado se incuba en aerobiosis a 37°C por 24 horas.
Concluido el tiempo se observa si hubo o no producción de H2S y se lee la motilidad. Por último se revela el indol, agregando 3 a 4 gotas del reactivo de Ehrlich o Kovac´s, se mezcla suavemente y se interpreta.
Como control de esterilidad se incuba uno o dos tubos sin inocular en estufa a 37°C por 24 horas. Se espera que al cabo de este tiempo no exista crecimiento, ni cambio de color.
Como control de calidad se pueden usar cepas conocidas certificadas, tales como: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
Los resultados esperados son: Escherichia coli H2S negativo, indol y motilidad positivo, Enterobacter aerogenes únicamente motilidad positivo, Salmonella typhimurium H2S y motilidad positivo, con indol negativo. Proteus vulgaris todo positivo, en tanto que Klebsiella pneumoniae y Shigella sonnei todo negativo.
-Algunas cepas de Morganella morganii, entre otras cepas pueden producir un pigmento parduzco en este medio debido a la producción de melanina, esto no debe confundirse con el precipitado de sulfuro ferroso. En profesionales inexpertos esta situación puede generar falsos positivos en la interpretación de la prueba de H2S.
-Las bacterias aerobias estrictas crecerán únicamente en la superficie del tubo, lo que dificulta la interpretación de la motilidad.
- Laboratorios BD. BBL SIM Medium. 2008. Disponible en: bd.com
- Laboratorios Neogen. SIM Medium. Disponible en: foodsafety
- Difco Francisco Soria Melguizo. SIM Medium. 2009. Disponible en: http://f-soria.es
- Laboratorio Brizuela-Lab. SIM Medio. Disponible en: .brizuela-lab.com
- Laboratorios Britania. SIM Medio. 2015. Disponible en: studyres.es/doc
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
