Einstenio (Es): estructura, propiedades, obtención, usos
El einstenio es un elemento químico que pertenece a la clase de los actínidos o actinoides. Su número atómico es 99 y se representa mediante el símbolo Es. Se trata de un elemento sintético, pues no se ha encontrado en ningún mineral ni material terrestre. Fue descubierto en 1952 en restos de la primera prueba de explosión de la bomba de hidrógeno.
Los actinoides son una serie cuyo primer miembro es el actinio y forman parte de los llamados elementos de transición interna. El einstenio además es el séptimo elemento transuránico, pues se ubica siete lugares más adelante del uranio en la tabla periódica de los elementos.

Es un sólido muy radiactivo y una vez formado comienza a desintegrarse formando otros elementos, lo que ha hecho muy difícil estudiarlo. Aunque el número de isótopos posibles del einstenio es grande, solo se ha descubierto menos del 20%.
El einstenio no posee usos comerciales. Es producido en muy pequeñas cantidades en laboratorios nucleares y se destina únicamente a experimentos científicos. Además, los investigadores en tales ensayos lo utilizan en muy pocos microgramos y con las debidas precauciones, pues la exposición a sus radiaciones es letal.
Índice del artículo
- 1 Nomenclatura
- 2 Descubrimiento
- 3 Estructura electrónica
- 4 Propiedades del einstenio
- 5 Obtención actual
- 6 Usos
- 7 Referencias
- Einstenio, símbolo químico: Es
- Einstenio-253, Es-253 o 253Es: isótopo del einstenio con una masa atómica de 253.
Este elemento fue identificado por primera vez por Albert Ghiorso (científico nuclear de los EEUU) y sus colaboradores en diciembre de 1952 en fragmentos dispersados por la explosión termonuclear de la primera prueba de la bomba de hidrógeno.
Esta bomba H, denominada “Ivy Mike” y también “la salchicha” por su forma, fue detonada en noviembre del mismo año en una isla perteneciente a un atolón de corales del Pacífico.

Para detonarla se había empleado una bomba de fisión de uranio. Los átomos de este último capturaron varios neutrones durante la explosión y sufrieron diversos pasos de decaimiento beta, en cada uno de los cuales se emite un electrón y un protón, que condujeron a la formación del einstenio-253, un isótopo del Es.
Un isótopo es una variante del mismo elemento que posee diferente cantidad de neutrones en el núcleo del átomo, por lo que tiene el mismo número atómico (en este caso 99) pero distinta masa atómica. El número del isótopo indica su masa atómica.
Al principio el trabajo fue mantenido en secreto, pero tras un año los autores decidieron publicarlo por temor a que otros científicos independientes pudieran producirlo en otros laboratorios, obtener el crédito del descubrimiento y asignar el nombre al elemento.
Por lo que desde noviembre de 1953 hasta marzo 1954 reportaron cuatro de sus isótopos. Finalmente en verano de 1955 se anunció el descubrimiento del nuevo elemento einstenio con número atómico 99.
Es importante notar que la recolección de las muestras de la explosión termonuclear cobró la vida del primer teniente Jimmy Robinson, quien estuvo mucho tiempo expuesto a la radiación de estas.
Se escogió el nombre de “einstenio” porque Albert Einstein sentó algunas de las bases de la teoría cuántica que luego explicarían cómo interaccionan los átomos entre sí.
Lo más significativo de la presencia de su nombre es la aplicación de su famosa ecuación E=mc2, que explica la conversión de masa en energía en las armas más destructivas creadas por el ser humano.

Los autores del descubrimiento sugirieron que el elemento tuviese el símbolo “E”, pero en 1957 la Unión Internacional de Química Pura y Aplicada, o IUPAC (siglas del inglés International Union of Pure and Applied Chemistry), cambió el símbolo a “Es”.
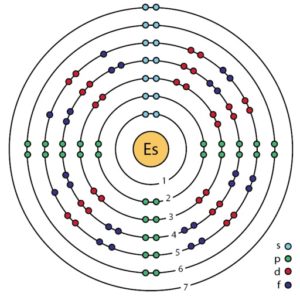
Su configuración electrónica es:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10 4f14; 5s2 5p6 5d10; 6s2 6p6; 5f11 7s2,
o en forma resumida:
[Rn] 5f11 7s2,
donde [Rn] es la estructura electrónica del gas noble radón (el cual también es radiactivo).
Sólido metálico a temperatura ambiente.
252,083
860 ºC
996 ºC
Los estudios con 253Es muestran que su comportamiento es el que se observa típicamente en un elemento actínido trivalente, es decir, en sus reacciones predomina la valencia +3.
Algunos de los compuestos con estado de oxidación +3 se han caracterizado, como el cloruro (EsCl3), el bromuro (EsBr3), el yoduro (EsI3), el oxicloruro (EsOCl) y el óxido (Es2O3).
Sin embargo, se han reportado también las valencias +2 y +4, aunque no se han confirmado. En este caso sería el primer metal divalente de la serie de los actínidos.
Los datos cristalográficos de rayos X de este elemento y sus compuestos son muy difíciles de obtener debido a que su desintegración espontánea produce radiación gamma y rayos X que sobreexponen el detector del instrumento y la película.
Hasta ahora se han descubierto 19 isótopos del Es con masas atómicas entre 241 y 257, y 3 isómeros. Ninguno es estable. Sin embargo, de todos los posibles isótopos del einstenio han sido producidos e identificados menos del 20%.
Su isótopo más estable es el einstenio-252, el cual tiene una vida media de 471,7 días. Se desintegra a berkelio-248 a través de la emisión de una partícula alfa (formada por 2 protones y 2 neutrones) o se convierte en californio-252 mediante la captura de un electrón.
Hoy en día el einstenio es producido mediante una cadena larga de reacciones nucleares que involucra el bombardeo de cada isótopo de la cadena con neutrones y al final el isótopo resultante sufre decaimiento beta.
En el decaimiento o desintegración beta el núcleo del átomo emite una partícula beta, que puede ser un electrón o un positrón, para equilibrar la relación neutrones/protones en el núcleo del átomo.
En los laboratorios de Oak Ridge de Estados Unidos se han producido cerca de 3 microgramos (μg) en el Reactor de Alto Flujo de Isótopos o HFIR (siglas del inglés High Flux Isotope Reactor). Un microgramo es la millonésima parte de un gramo, es decir, equivale a 0,000001 gramo.
El método ha sido el siguiente:
- Durante varios años se irradiaron cantidades grandes (kilogramos) de 239Pu (polonio-239) para producir 242Pu.
- Se convirtió el 242Pu en óxido de plutonio y se mezcló con óxido de aluminio Al2O3 para formar esferas comprimidas.
- Las esferas del material se incorporaron a barras especiales para ser irradiadas durante un año en la Planta de Savannah River en Estados Unidos.
- Luego se irradiaron las barras en el HFIR durante 4 meses más.
- Por último, el material resultante se sometió a procedimientos químicos para separar el einstenio de los isótopos de californio (hijos del Es).
En operaciones especiales del HFIR se pueden obtener hasta unos 2 miligramos (mg) de einstenio.
Este elemento solamente se ha producido en cantidades muy pequeñas, además es muy radiactivo, por lo que no tiene ningún uso comercial. Actualmente tiene aplicación solo en investigaciones científicas básicas.
En 1961 se logró producir una cantidad macroscópica de 253Es con un peso de 0,01 microgramos (μg) medido con una balanza especial de tipo magnético. Esta muestra luego se bombardeó con neutrones para producir el elemento mendelevio (número atómico 101).
La autoemisión intensa de radiación del einstenio puede utilizarse para estudiar el envejecimiento acelerado y los daños ejercidos por las radiaciones.
Por ejemplo, se ha usado en estudios sobre las consecuencias químicas de la desintegración radiactiva.
Debido a la relativamente corta vida media del Es-253 (20,47 días), se puede estudiar tanto el crecimiento interno de su isótopo hijo Bk-249, cuya vida media es de 330 días, como el del nieto Cf-249 (vida media de 351 años).
Ciertos datos sugieren que el Es divalente podría decaer a berkelio divalente y posiblemente a un californio divalente (aún desconocido).
Es el elemento más pesado con el cual se pueden realizar estudios que posibilitan el desarrollo de investigaciones fundamentales acerca del papel que juegan los electrones 5f en la organización y clasificación de los actínidos.
El Es-252 está disponible solo en cantidades mínimas. Los isótopos Es-253 (vida media 20,47 días) y Es-254 (275,7 días) tienen una vida media más larga y se tiene una mayor disponibilidad de estos, por lo que se emplean en estudios fisicoquímicos.
Sin embargo, usualmente en los experimentos se emplean solo unos pocos microgramos (μg) para reducir la exposición de los trabajadores y minimizar los efectos de la intensa autoirradiación.

Se estima que se podría emplear para tratamientos médicos de radiación dirigidos a ciertos órganos.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- PubChem (2020). Einsteinium – Es (Element). Recuperado de pubchem.ncbi.nlm.nih.gov.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Meierfrankenfeld, D. et al. (2011). Discovery of scandium, titanium, mercury, and einsteinium isotopes. Atomic Data and Nuclear Data Tables 97 (2011) 134-151. Recuperado de sciencedirect.com.
- Royal Society of Chemistry. (2020). Einsteinium. Recuperado de rsc.org.
- Ross, R. (2017). Facts about Einsteinium. Recuperado de livescience.com.
