Reacción de desplazamiento: qué es, tipos, ejemplos

¿Qué es una reacción de desplazamiento?
La reacción de desplazamiento o reacción de sustitución es un tipo de reacción química en la que un átomo o un pequeño grupo de átomos en una molécula es reemplazado o desplazado por otro átomo o grupo de átomos.
Las reacciones de desplazamiento pueden ser simples o dobles, y son muy comunes en la naturaleza. Muchas de las reacciones químicas que vemos a diario son reacciones de desplazamiento, como por ejemplo, la sulfatación de los bornes en las baterías de los automóviles.
Tipos de reacciones de desplazamiento
Existen dos tipos de reacciones de desplazamiento, las simples y las dobles, que se describen a continuación junto con algunos ejemplos específicos:
Reacción de desplazamiento simple
Estas son reacciones de desplazamiento en las que un elemento sustituye a otro en un compuesto químico. Se reconocen porque tanto en los reactivos como en los productos hay solo dos sustancias involucradas, y en cada caso una de ellas es un elemento puro mientras que la otra es un compuesto.
Estas reacciones pueden tener una de las siguientes ecuaciones generales:
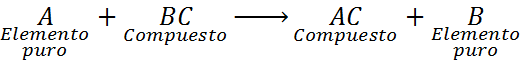
Como se puede ver, en esta reacción el elemento A reacciona con el compuesto BC y desplaza o reemplaza al elemento B para formar el compuesto AC.
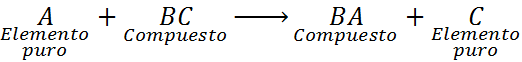
En este caso, el elemento A reacciona también con el compuesto BC, pero desplaza o reemplaza al elemento C para formar el compuesto BA, liberando a C en forma de un elemento puro.
Una de las características más importantes para reconocer una reacción de desplazamiento simple es que el elemento entrante (A) debe terminar ocupando el mismo sitio que ocupaba el elemento saliente (B o C, según sea el caso) y este debe terminar como un elemento puro.
Cabe resaltar que, en muchos casos, la parte C de la molécula no necesariamente es un elemento individual, sino que puede tratarse de un grupo de átomos tal como iones nitrato (NO3–) o sulfato (SO4–).
Ejemplos de reacciones de desplazamiento simple
– Desplazamiento de plata por el cobre
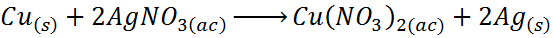
En este caso, el cobre (Cu) hace las veces del elemento A, la plata (Ag) corresponde al elemento B y los iones nitrato (NO3–) representan a C.
Como se puede observar, en esta reacción el cobre reemplaza a la plata en el nitrato de plata, liberando a la plata en forma elemental.
– Sulfatación de los bornes de la batería

Esta reacción de desplazamiento simple es la que sucede en los bornes o contactos eléctricos de muchos acumuladores de plomo, es decir, las baterías presentes en la mayoría de los automóviles a gasolina.
La reacción se evidencia por la formación de un sólido de color blanco que cubre los contactos de plomo de dichas baterías. Como se puede ver en la ecuación, esta es una reacción en la que el plomo desplaza al hidrógeno en el ácido sulfúrico.
– Desplazamiento de bromo por flúor

En este caso, el flúor, que es un elemento muy reactivo, reemplaza al bromo en el bromuro de sodio (NaBr) para formar fluoruro de sodio (NaF). Nótese que aquí el elemento que se reemplaza no es el que aparece de primero en la fórmula del compuesto, sino que se trata del segundo, como en la segunda forma de la reacción general mostrada anteriormente.
Reacción de desplazamiento doble
Las reacciones de desplazamiento doble, también llamadas reacciones de doble reemplazo o de doble descomposición, se pueden ver como un intercambio de parejas. Son reacciones en las que dos compuestos químicos diferentes intercambian elementos para formar dos compuestos nuevos distintos. Estas reacciones tienen la siguiente ecuación general:
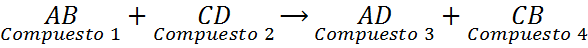
Como se puede ver en esta reacción general, el elemento A del compuesto 1 (AB) reemplaza al elemento C del compuesto 2 (CD) para formar así el compuesto 3 (AD). Al mismo tiempo, el elemento C del compuesto 2 (CD) reemplaza al elemento A del compuesto 1 (AB) para formar el compuesto 4 (CB).
En los desplazamientos dobles es esencial que los elementos que se sustituyen entre sí ocupen posiciones equivalentes en los compuestos nuevos. Esto quiere decir que, en la reacción general, A, que está a la izquierda y por lo tanto probablemente se trata de un catión, solo puede reemplazar a C en el compuesto CD, pero no puede reemplazar a D.
Esto es similar a un intercambio de parejas de baile. Si todas las parejas están formadas por un hombre y una mujer, las nuevas parejas formadas luego de la reacción también deben estar formadas por un hombre y una mujer.
Ejemplos de reacciones de desplazamiento doble
– Reacción entre cloruro de sodio y nitrato de plata

Este es un ejemplo claro de una reacción de doble desplazamiento. Aquí, el sodio reemplaza a la plata en el nitrato de plata para formar así el nitrato de sodio (NaNO3), al mismo tiempo que la plata reemplaza al sodio en el cloruro de sodio para formar el cloruro de plata (AgCl).
– Reacción entre sulfato de calcio y cloruro de sodio

En esta reacción de desplazamiento doble, el calcio reemplaza al sodio en el cloruro de sodio para formar el cloruro de calcio mientras que el sodio reemplaza al calcio en el sulfato de calcio para formar así el sulfato de sodio.
Otra manera de ver a esta reacción que es igualmente válida, es que el sulfato está reemplazando al cloruro en el cloruro de sodio para formar el sulfato de sodio mientras que el cloruro está reemplazando al sulfato.
A pesar de que ambas formas son igualmente aceptables, la primera es más común que la segunda.
– Reacción entre el ácido sulfúrico y el hidróxido de potasio
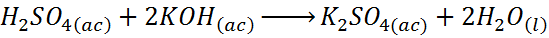
La reacción entre el ácido sulfúrico y el hidróxido de potasio es una reacción de neutralización ácido base, pero también es una reacción de desplazamiento doble.
En este caso, el hidrógeno está reemplazando al potasio en el hidróxido de potasio para formar agua, mientras que el potasio reemplaza al hidrógeno en el ácido sulfúrico para formar sulfato de potasio.
