Compuestos cuaternarios: características, formación, ejemplos
Los compuestos cuaternarios son todos aquellos que poseen cuatro átomos o iones diferentes. Por lo tanto, pueden tratarse de especies moleculares o iónicas. Sus diversidades abarcan tanto la química orgánica como la inorgánica, siendo un grupo muy voluminoso; aunque quizás, no tanto en comparación con los compuestos binarios o ternarios.
La razón de que su número sea más pequeño se debe a que los cuatros átomos o iones deben mantenerse unidos por sus afinidades químicas. No todos los elementos son compatibles entre sí, y menos aun cuando se considera un cuarteto; de repente un par de ellos son más afines entre ellos que con el otro par.
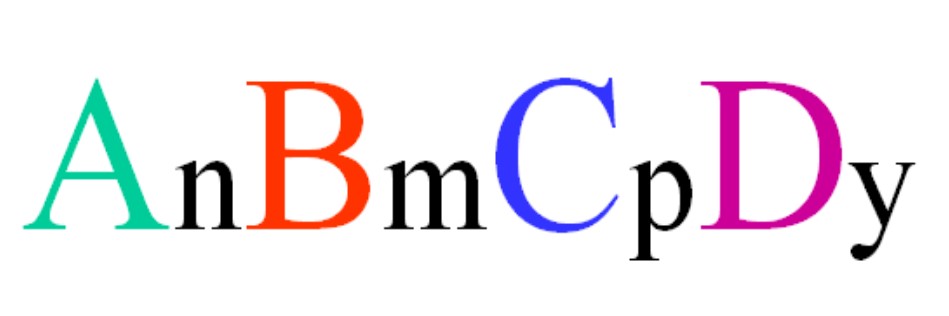
Considérese un compuesto cuaternario de fórmula aleatoria ABCD. Los subíndices n, m, p e y, son los coeficientes estequiométricos, que a su vez indican qué proporción de cada átomo hay en relación a los demás.
Así pues, la fórmula AnBmCpDy será válida si cumple con la electroneutralidad. Además, tal compuesto será posible si sus cuatros átomos son lo suficiente afines unos con otros. Se verá que esta fórmula no se aplica para muchos compuestos, sino sobre todo para aleaciones o minerales.
Índice del artículo
Un compuesto cuaternario puede ser iónico o covalente, exhibiendo las características esperadas para su naturaleza. Los compuestos ABCD iónicos es de esperar que sean solubles en agua, alcoholes o en otros solventes polares; deben tener puntos de ebullición y fusión altos, y ser buenos conductores de la electricidad cuando se funden.
Respecto a los compuestos ABCD covalentes, la mayoría consisten de compuestos orgánicos nitrogenados, oxigenados o halogenados; es decir, su fórmula pasaría a ser CnHmOpNy o CnHmOpXy, siendo X un átomo de halógeno. De estas moléculas sería lógico pensar que fueran polares, dada las altas electronegatividades del O, N y X.
Un compuesto ABCD puramente covalente, puede tener muchas posibilidades de enlace: A-B, B-C, D-A, etc., dependiendo evidentemente de las afinidades y capacidades electrónicas de los átomos. Mientras que en un compuesto ABCD puramente iónico, sus interacciones son electrostáticas: A+B–C+D–, por ejemplo.
En el caso de una aleación, considerada más una mezcla sólida que un compuesto propiamente hablando, ABCD consisten de átomos neutros en estados basales (en teoría).
Del resto, un compuesto ABCD puede ser neutro, ácido o básico, dependiendo de la identidad de sus átomos.
Físicamente hablando, es probable que ABCD no llegue a ser un gas, debido a que cuatro átomos diferentes implican siempre una mayor masa molecular o formular. Si no es un líquido con alto punto de ebullición, es de esperarse que se trate de un sólido, cuya descomposición debe generar muchos productos.
Nuevamente, sus colores, olor, textura, cristales, etc., estarán sujetos a cómo coexisten A, B, C y D en el compuesto, y dependerán de su sinergia y estructuras.
Hasta el momento se ha abordado el tema de los compuestos cuaternarios de manera global e imprecisa. Dejando a un lado la química orgánica (amidas, cloruros de bencilo, sales de amonio cuaternario, etc.), en la química inorgánica hay ejemplos bien definidos llamados Oxisales ácidas y básicas.
Las oxisales ácidas son aquellas que derivan de la neutralización parcial de un oxoácido poliprótico. Así, uno o más de sus hidrógenos son sustituidos por cationes metálicos, y cuantos menos hidrógenos remanentes posea, menos ácida será.
Por ejemplo, del ácido fosfórico, H3PO4, pueden obtenerse hasta dos sales ácidas de, a decir, sodio. Estas son: NaH2PO4 (Na+ sustituye a un hidrógeno equivalente a H+) y Na2HPO4.
De acuerdo a la nomenclatura tradicional, estas sales se nombran al igual que las oxisales (totalmente desprotonadas), pero antecediéndo la palabra ‘ácido’ al nombre del metal. Así, el NaH2PO4 vendría a ser el fosfato diácido de sodio, y el Na2HPO4 fosfato ácido de sodio (porque le queda un H).
Por otro lado, la nomenclatura stock prefiere utilizar la palabra ‘hidrógeno’ que ‘ácido’. El NaH2PO4 vendría a ser entonces Dihidrógenofosfato de sodio, y el Na2HPO4 hidrógeno fosfato de sodio. Nótese que estas sales tienen cuatro átomos: Na, H, P y O.
Las oxisales básicas son aquellas que contienen en su composición al anión OH–. Por ejemplo, considérese la sal CaNO3OH (Ca2+ NO3– OH–). Para nombrarla, bastaría con anteceder la palabra ‘básico’ al nombre del metal. Así, su nombre sería: nitrato básico de calcio. ¿Y qué tal el CuIO3OH? Su nombre sería: yodato básico cúprico (Cu2+ IO3– OH–).
De acuerdo a la nomenclatura stock, se sustituye la palabra ‘básico’ por hidróxido, seguido del uso de un guión antes del nombre del oxoanión.
Repitiendo los ejemplos anteriores sus nombres vendrían a ser para cada uno: Hidróxido-nitrato de calcio, e hidróxido-yodato de cobre (II); recordando que la valencia del metal debe estar indicada entre paréntesis y con números romanos.
En las sales dobles hay dos cationes diferentes interaccionando con un mismo tipo de anión. Supóngase la sal doble: Cu3Fe(PO4)3 (Cu2+ Fe3+ PO43-). Es un fosfato de hierro y cobre, pero el nombre más apropiado para referirse a este es: fosfato triple de cobre (II) y hierro (III).
Estos son los hidratos, y la única diferencia es que al final de sus nombres se especifica el número de agua formular. Por ejemplo, el MnCl2 es el cloruro de manganeso (II).
Su hidrato, MnCl2·4H2O viene a llamarse cloruro de manganeso (II) tetrahidratado. Nótese que hay cuatro átomos diferentes: Mn, Cl, H y O.
Una sal doble e hidratada famosa es la de Mohr, Fe(NH4)2(SO4)2·6H2O. Su nombre es: sulfato doble de hierro (II) y amonio hexahidratado.
Nuevamente, centrándonos en los compuestos cuaternarios inorgánicos, se tiene que en su mayoría son producto de neutralizaciones parciales. Si estas ocurren en presencia de varios óxidos metálicos, es probable que surjan las sales dobles; y si el medio es muy básico, precipitarán las oxisales básicas.
Y si además, por otro lado, las moléculas de agua tienen afinidad por el metal, se coordinarán directamente con él o con los iones que le rodean, formándose los hidratos.
Por el lado de las aleaciones, deben soldarse cuatro metales o metaloides diferentes para la fabricación de capacitores, semiconductores o transistores.
Para finalizar se muestra a continuación una lista con diferentes ejemplos de compuestos cuaternarios. El lector podrá utilizarla para poner a prueba sus conocimientos de nomenclatura:
– PbCO3(OH)2
– Cr(HSO4)3
– NaHCO3
– ZnIOH
– Cu2(OH)2SO3
– Li2KAsO4
– CuSO4·5H2O
– AgAu(SO4)2
– CaSO4·2H2O
– FeCl3·6H2O
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Nomenclatura y formulación inorgánica. [PDF]. Recuperado de: recursostic.educacion.es
- Erika Thalîa Bueno. (2019). Sales dobles. Academia. Recuperado de: academia.edu
- Wikipedia. (2019). Quaternary ammonium cation. Recuperado de: en.wikipedia.org
