Tiocianato de potasio (KSCN): estructura, propiedades, usos
El tiocianato de potasio es un compuesto inorgánico formado por los elementos potasio (K), azufre (S), carbono (C) y nitrógeno (N). Su fórmula química es KSCN. Es un sólido incoloro o blanco muy soluble en agua. Está formado por un ion potasio K+ y un ion tiocianato SCN–. El KSCN se encuentra en la saliva de forma abundante.
El tiocianato de potasio se utiliza como reactivo de laboratorio para diversos tipos de análisis químicos. También se utiliza en tintas y pinturas.

El KSCN ha sido empleado para disolver la gelatina de la dentina (material debajo del esmalte de los dientes) antes de aplicar el material o resina que repara los dientes. También es utilizado en investigaciones sobre vacunas, pues permite extraer ciertos elementos bioquímicos de las bacterias.
Es utilizado en forma de una solución donde se disuelven los metales durante el proceso de pulido por electricidad o electropulido. También ha sido empleado en la obtención de falsa sangre para películas y obras de teatro.
En ocasiones es usado indebidamente para aumentar la estabilidad de la leche cuando esta no se mantiene refrigerada. Pero tiene la desventaja de causar hipotiroidismo, una enfermedad en la cual la glándula tiroides funciona mal.
Índice del artículo
El tiocianato de potasio está formado por un catión potasio K+ y un anión tiocianato NCS–. Este último está formado por un nitrógeno (N) unido a un carbono (C) mediante un enlace triple y un azufre (S) unido al carbono mediante un enlace simple.
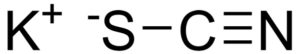
- Tiocianato de potasio
- Sulfocianato de potasio
- Sal potásica del ácido tiociánico
- Rodanato de potasio
- Rodanuro de potasio
Sólido incoloro o blanco.
97,18 g/mol
173 ºC
500 ºC
1,88 g/cm3
Muy soluble en agua: 217 g/100 mL a 20 °C, 238 g/100 mL a 25 °C. Soluble en etanol.
Una solución al 5% de KSCN posee un pH entre 5,3 y 8,7.
Las muestras de tiocianato de potasio puro y seco son estables indefinidamente si se mantienen en la oscuridad en frascos de vidrio bien tapados. Sin embargo, en contacto con luz directa del sol los cristales incoloros se vuelven amarillentos rápidamente.
Las soluciones de la sal de KSCN pura protegidas de la luz son completamente estables.
El KSCN es capaz de hinchar la gelatina y el colágeno. Las soluciones acuosas de tiocianato de potasio al reaccionar con dióxido de manganeso MnO2 se oxidan y forman tiocianógeno (SCN)2.
El tiocianato de potasio puede prepararse fundiendo el cianuro de potasio (KCN) con azufre (S). La reacción es rápida y cuantitativa.
KCN + S → KSCN
Se puede obtener en solución disolviendo azufre (S) en benceno o acetona y agregando una solución de cianuro de potasio (KCN) en isopropanol. Esta reacción sirve para analizar la cantidad de azufre de una solución.
El tiocianato de potasio puede obtenerse puro mediante sucesivas recristalizaciones desde agua o etanol.
El tiocianato de potasio se encuentra en la saliva de forma abundante (15 mg/100 mL), pero se encuentra ausente en la sangre.
También la leche de algunos mamíferos (como la vaca) posee cantidades muy pequeñas de tiocianato de forma natural.
El tiocianato de potasio ha sido utilizado en diversos análisis químicos. Se ha empleado para el análisis o titulación de ion plata, también como reactivo e indicador de otros análisis.
El KSCN se emplea en colorantes y pigmentos. Se usa en pinturas y tintas.
En la industria de la fotografía se utiliza especialmente en la manufactura de películas para fotografía, pues sirve para permitir la deposición firme de la gelatina de las películas plásticas.
La concentración de tiocianato en sangre se ha utilizado en experiencias medicocientíficas para determinar el grado en que fuman algunas personas, pues el tiocianato es un producto derivado del cianuro de hidrógeno (HCN) presente en el humo del tabaco.
El tiocianato de potasio se ha empleado en la reparación de dientes de animales. Se ha aplicado con éxito a la superficie de la dentina como pretratamiento antes de aplicar el agente para obturar o taponar el orificio abierto.
La dentina es la capa que se encuentra por debajo del esmalte de los dientes.
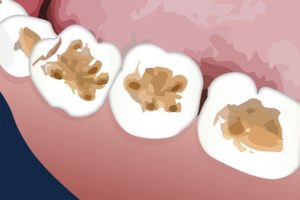
El tiocianato de potasio favorece el hinchamiento de la gelatina que se encuentra sobre la dentina, por lo que esta capa es removida fácilmente y resulta una mejor adhesión o pegado del material que obtura el diente (resina).
EL KSCN se utiliza en la preparación de vacunas o extractos de bacterias.
Se hace crecer la bacteria patógena mediante incubación en recipientes adecuados de laboratorio. Luego se añade un regulador de pH de fosfato y el KSCN al recipiente donde se encuentra el cultivo de bacterias.
Se toma una porción de este preparado de bacterias y se coloca en un frasco. Se agita durante un tiempo adecuado y la suspensión se centrifuga para separar el líquido del material sólido. El sobrenadante (líquido) se recoge y se dializa.
El resultado es un extracto que se utiliza para vacunar en experiencias científicas con animales de laboratorio.
El tiocianato de potasio se utiliza en el electropulido de metales. El electropulido es un proceso químico que permite tratar la superficie de un metal para reducir su microrugosidad, es decir, alisar la superficie metálica.
Esto se realiza con electricidad, haciendo que el metal a alisar actúe como polo positivo o ánodo de la celda electrolítica. Las rugosidades se disuelven en la solución de tiocianato de potasio y el metal queda así más liso.
El KSCN se utiliza en la simulación de sangre en películas de cine y televisión o en obras de teatro.
Por ejemplo, se aplica una solución de tiocianato de potasio (KSCN) a la zona del cuerpo que “sufrirá” el corte o agresión simulada. Se baña el cuchillo plástico o simulación de objeto cortante en una solución de cloruro férrico (FeCl3).
Se pasa suavemente el objeto “cortante” que tiene FeCl3 sobre la piel humedecida en KSCN. Inmediatamente se formará una raya o mancha de color rojo muy similar al de la sangre.
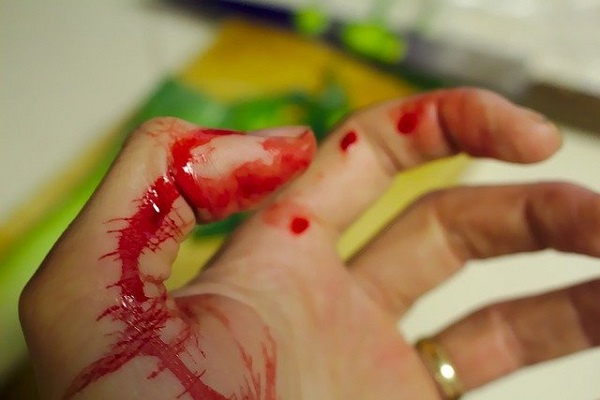
Esto se debe a la formación de un complejo de tiocianato férrico y agua [Fe(NCS)(H2O)5]2+ el cual es de color rojo intenso muy parecido a la sangre:
KSCN + FeCl3 + 5 H2O → [Fe(NCS)(H2O)5]2+ + 2 Cl– + KCl

El tiocianato de potasio es utilizado de forma inescrupulosa para evitar que la leche sea atacada por bacterias u hongos, pierda sus propiedades y se deteriore.
En países tropicales se utiliza un método denominado “sistema de lacto-peroxidasa” o sistema LP, el cual incrementa la estabilidad de la leche al almacenamiento a altas temperaturas ambientales, cuando su refrigeración no es posible.

Dicho método utiliza el sistema natural antibacterial de la leche, el cual se activa aumentando la concentración del tiocianato (ya presente en pequeñas cantidades en la leche) y del peróxido de hidrógeno (H2O2).
Sin embargo, este método no está permitido en muchos países por las autoridades que regulan los alimentos procesados.
Algunas personas sin escrúpulos añaden KSCN a la leche de forma irracional con o sin H2O2, lo que constituye un peligro para la salud del consumidor, pues los tiocianatos son sustancias que provocan daño a la tiroides y pueden originar hipotiroidismo cuando se ingieren en altas concentraciones.

Se debe evitar inhalar el polvo de tiocianato de potasio. Es conveniente utilizar guantes y lentes de protección al manipularlo. Tras una breve exposición al tiocianato de potasio este puede causar efecto sobre el sistema nervioso, tal como excesiva emoción sin motivos, agitación y convulsiones.
Tras una larga exposición se pueden ver afectados la tiroides y el sistema nervioso central, lo cual se manifiesta como hipotiroidismo y deterioro de algunas funciones respectivamente. Al ser ingerido puede causar confusión, nausea, vómitos, convulsiones y debilidad.
Si el KSCN se enciende o quema se liberan gases de cianuro altamente venenosos; esto ocurre también al añadir ácidos. En el laboratorio debe manipularse en el interior de una campana de extracción muy bien ventilada.
- Jarvinen, L.Z. et al. (1998). Induction of Protective Immunity in Rabbits by Coadministration of Inactivated Pasteurella multocida Toxin and Potassium Thiocyanate Extract. Infection and Immunity, Aug, 1998, p. 3788-3795. Recuperado de ncbi.nlm.nih.gov.
- Tani, Y. and Togaya, T. (1995). Dentin Surface Treatment without Acids. Dental Materials Journal 14 (1): 58-69, 1995. Recuperado de jstage.jst.go.jp.
- Kolthoff, I.M. and Lingane, J.J. (1935). Potassium Thiocyanate as a Primary Standard Substance. Journal of the American Chemical Society 1935, 57, 11, 2126-2131. Recuperado de pubs.acs.org.
- Balmasov, A.V. et al. (2005). Electropolishing of Silver in Water-Organic Solutions of Potassium Thiocyanate. Prot Met 41, 354-357 (2005). Recuperado de link.springer.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Tyner, T. and Francis, J. (2017). Potassium Thiocyanate. ACS Reagent Chemicals. Recuperado de pubs.acs.org.
- Kanthale, P. et al. (2015). Qualitative test for the detection of extraneous thiocyanate in milk. J Food Sci Technol (March 2015) 52(3):1698-1704. Recuperado de ncbi.nlm.nih.gov.
- Roy, D. et al. (2018) Silicon Quantum Dot-Based Fluorescent Probe: Synthesis Characterization and Recognition of Thiocyanate in Human Blood. ACS Omega 2018, 3, 7, 7613-7620. Recuperado de pubs.acs.org.
- Gammon, K. (2018). The Science of Fake Blood. Inside Science. Recuperado de insidescience.org.
