Agar Endo: fundamento, preparación y uso
El agar Endo o medio Endo es un medio de cultivo sólido, diferencial y con cierto grado de selectividad. La fórmula original fue creada por Endo en 1904 para diferenciar las bacterias fermentadoras de la lactosa de las no fermentadoras. En un inicio se diseñó para el aislamiento de Salmonella typhi, pero posteriormente el objetivo del medio se volcó a la búsqueda de coliformes.
El principio del agar Endo se ha mantenido, pero su formulación ha sufrido innumerables cambios a través de los años. Actualmente, el medio se compone de digerido péptico de tejido animal, lactosa, fosfato dipotásico de hidrógeno, sulfito sódico, fucsina básica y agar.
El uso principal del medio ha estado ligado al aislamiento y diferenciación de bacilos Gram negativos pertenecientes a la familia Enterobacteriaceae y a otras familias cercanas.
Por mucho tiempo fue utilizado en la detección de coliformes en muestras de agua, lácteos y alimentos, pero hoy día se ha desplazado el uso de este medio por otros de funciones similares. Sin embargo, algunos laboratorios de microbiología utilizan este agar para el aislamiento de enterobacterias a partir de muestras de origen clínico.
Índice del artículo
El agar Endo contiene peptonas que sirven como fuente de aminoácidos, nitrógeno, carbono y energía, necesarios para el crecimiento de microorganismos poco exigentes.
Por otra parte, el carácter ligeramente selectivo del agar se lo proporciona el agregado de sulfito sódico y la fucsina básica; ambos componentes inhiben parcial o totalmente el desarrollo de la mayoría de las bacterias Gram positivas.
El carácter diferencial viene dado por la presencia del carbohidrato fermentable, que en este caso es la lactosa y la fucsina básica, que también sirve de indicador de pH.
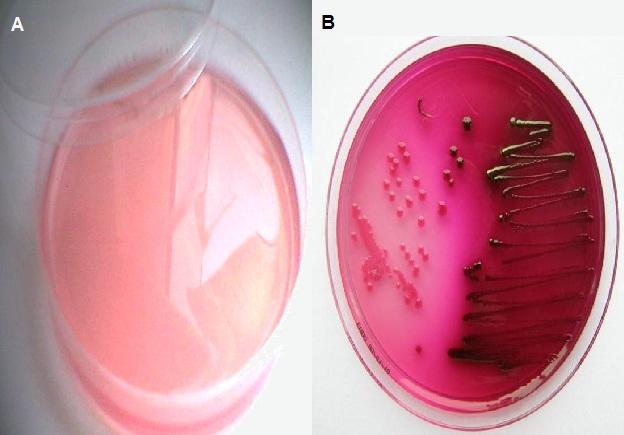
Las bacterias Gram negativas que crecen en este agar y son capaces de fermentar la lactosa formarán colonias de color rosado fuerte; siendo patognomónico de Escherichia coli la formación de colonias rojo oscuro con un brillo metálico verdoso tornasolado. Esto se debe a la alta producción de ácidos a partir de la fermentación del carbohidrato.
Cabe destacar que el medio que se encuentra alrededor de las colonias también vira a un color rosado fuerte. Mientras que los bacilos Gram negativos no fermentadores de la lactosa forman colonias de color rosado pálido similar al medio o incoloras.
El fosfato dipotásico de hidrógeno equilibra el pH del medio y el agar es el componente que brinda la consistencia sólida.
Pesar 41,5 gr del medio deshidratado y disolver en 1 litro de agua destilada. Calentar la mezcla agitando frecuentemente hasta que haya disolución total del medio. Esterilizar en autoclave a 121°C, a 15 lb de presión, por 15 minutos.
Al sacar del autoclave, dejar enfriar hasta una temperatura aproximada de 45-50°C, agitar la mezcla para homogeneizar antes de servir. Verter 20 ml en placas de Petri estériles.
Dejar solidificar las placas, invertir y guardar en plaquero o envolver con papel oscuro antes de guardar en nevera. Es muy importante proteger el medio preparado de la luz directa. Una práctica recomendada es preparar la cantidad exacta que se va a necesitar.
Si se guardan en nevera se debe dejar atemperar las placas antes de usar.
El pH del medio debe quedar entre 7,2 a 7,6 y el color del medio preparado es color rosado pálido.
Existe otra versión del agar Endo (m-Endo) que sigue la fórmula de McCarthy, Delaney y Grasso, que contiene más compuestos y varía en la forma de preparación.
Esta variante contiene: lactosa, triptosa, digerido enzimático de caseína, digerido enzimático de tejido animal, cloruro de sodio, fosfato de potasio dibásico, sulfito de sodio, extracto de levadura, fosfato de potasio monobásico, fucsina básica, desoxicolato de sodio, lauril sulfato de sodio y agar.
En este caso, se pesa 51 gr del medio deshidratado y se suspende en 1 litro de agua destilada que contenga 20 ml de etanol.
Calentar ligeramente mientras se agita hasta disolver el medio completamente. No se debe sobrecalentar y tampoco esterilizar en autoclave. Una vez homogénea la mezcla servir en placas de Petri estériles y dejar solidificar.
En algunos países aún se utiliza para el recuento de coliformes totales y fecales en muestras de agua y alimentos, especialmente se busca la presencia de Escherichia coli como principal indicador de contaminación fecal.
El agar m-Endo es recomendado por la American Public Health Association (APHA) para el seguimiento y control de los programas de desinfección y tratamiento de aguas residuales, así como también en la evaluación de la calidad del agua potable.
El método más utilizado es el de filtración por membrana, previo enriquecimiento de la muestra con caldo Lauryl sulfato por 2 a 4 horas.
También puede usarse como sustituto del agar EMB en el análisis microbiológico de alimentos y aguas por la técnica del número más probable (NMP), específicamente en la fase completa confirmatoria para corroborar la presencia de E. coli a partir de caldos EC turbios.
Para evaluar la calidad del lote de agar Endo preparado se siembran cepas controles conocidas o certificadas.
Entre las cepas que pueden utilizarse para esta finalidad están: Escherichia coli ATCC 25922, Escherichia coli ATCC 11775, Enterobacter cloacae ATCC 13047, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella flexneri ATCC 12022, Proteus mirabilis ATCC 14153 y Enterococcus faecalis ATCC 11700.
Las cepas se siembran por agotamiento y se incuban a 37°C por 24 horas en aerobiosis.
Los resultados esperados son:
- Para Escherichia coli: colonias rojo fuerte, con brillo metálico.
- Para E. cloacae y K. pneumoniae las colonias deben ser mucoides color rosa.
- En el caso de S. typhimurium, S. flexneri y P. mirabilis las colonias suelen ser rosa pálido o incoloras.
- Finalmente, E. faecalis se espera que sea inhibido parcialmente, por consiguiente su crecimiento debe ser pobre con colonias muy pequeñas de color rosa fuerte.
-El medio Endo tiene bajo poder selectivo, por tanto, es posible que puedan crecer algunos microorganismos Gram positivos como Staphylococcus, Enterococcus y hasta levaduras.
-Otros bacilos no pertenecientes a la Familia Enterobacteriaceae pueden desarrollarse en este medio, como por ejemplo Pseudomonas sp y Aeromonas sp. Las características de estas cepas son colonias irregulares incoloras.
-Este medio preparado es muy sensible a la luz, por lo tanto, una exposición prolongada a esta deteriora el sistema indicador, dañando irreversiblemente el medio.
-Los componentes del medio son considerados cancerígenos, por ello debe evitarse el contacto directo.
-El medio deshidratado es muy higroscópico y debe mantenerse en su envase original a temperatura ambiente, bien cerrado y en un ambiente seco.
- Laboratorios BD. Endo Agar. 2013. Disponible en: bd.com
- Laboratorios Neogen. M Endo Agar. Disponible en: foodsafety.neogen.com
- “Agar Endo.” Wikipedia, La enciclopedia libre. 7 sep 2017, 08:27 UTC. 28 feb 2019, 22:55. Disponible en: es.wikipedia.
- Laboratorio MercK. Agar Endo. 2019. Disponible en: merckmillipore.com
- Laboratorios Technical Sheet. M –Endo Agar LES. 2015. Disponible en: liofilchem.net
