Radicales alquilo: cómo se forman, nomenclatura, ejemplos
Los radicales alquilo son un conjunto de moléculas inestables que se originan por la pérdida de hidrógenos de un alcano. Se caracterizan por tener un electrón desapareado, por lo que reaccionan rápidamente para completar el octeto de valencia del átomo donde se localiza.
Estos radicales se simbolizan con la letra R, al igual que los grupos alquilos, pero con la diferencia de que se le agrega un punto, R·. Este punto indica la presencia de un electrón desapareado. Por ejemplo, considérese el gas metano, CH4. Este alcano, al perder uno de sus hidrógenos, se transformará en el radical metilo, CH3· (imagen de abajo).
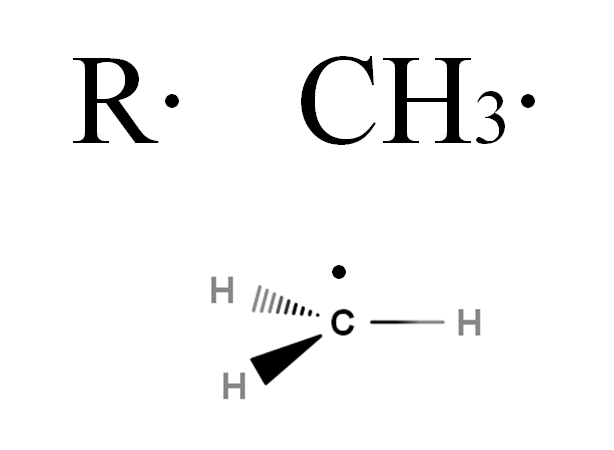
Si se desea profundizar un poco acerca de la estructura del radical CH3·, se verá que su electrón desapareado se encuentra en un ángulo perpendicular a los enlaces C-H; es decir, se localiza en un orbital p puro. Por lo tanto, el CH3· adopta una hibridación sp2, al igual que como sucede, generalmente, con los demás radicales alquilo.
Estos radicales son la piedra angular de las reacciones en cadena donde participan los alcanos, como es el caso de sus halogenaciones: cloración, bromación, etc. Existen radicales 1º, 2º y 3º, así como vinílicos y alílicos, cada uno con sus respectivas estabilidad y facilidad de formación.
Índice del artículo
- 1 ¿Cómo se forman los radicales alquilo?
- 2 Estabilidades relativas
- 3 Nomenclatura
- 4 Principales radicales alquilo
- 5 Referencias
La reacción “más simple” por la que se forman los radicales alquilo es la halogenación de los alcanos. Para que se formen, tiene que darse la reacción en cadena, la cual solo ocurre a altas temperaturas (superiores a 250 ºC), o bajo la incidencia de luz ultravioleta a temperatura ambiente.
Considérese la cloración del metano bajo una de las condiciones mencionadas arriba:
Cl2 → 2Cl·
La energía aportada es suficiente para romper el enlace Cl-Cl de la molécula de cloro, ocurriendo una ruptura homolítica; es decir, cada átomo de cloro se queda con uno de los electrones del enlace. Por lo tanto, se forman dos radicales Cl·.
Acto seguido, un radical Cl· ataca una molécula de metano:
Cl· + CH4 → HCl + CH3·
Y aparece el radical metilo. Este CH3· es bastante inestable, por lo que reaccionará inmediatamente para ganar un electrón extra con el cual apareará su electrón solitario:
CH3· + Cl2 → CH3Cl + Cl·
El Cl· formado reaccionará con otra molécula de metano y el ciclo se repetirá una y otra vez. A medida que se vaya agotando el metano, ocurrirán las siguientes reacciones que pondrán fin a la reacción en cadena:
Cl· + ·Cl → Cl2
CH3· + ·CH3 → CH3CH3
CH3· + ·Cl → CH3Cl
El metano no es el único alcano que se “radicaliza” mediante cloración. También sucede igual con el etano, propano, butano, y otros isómeros. Sin embargo, lo que sí varía es la energía necesaria que debe aportarse para que los radicales Cl· deshidrogenen a una molécula de alcano. En el caso del radical metilo, es muy inestable y, por lo tanto, difícil de formar.
Es así pues, que el radical CH3CH2· es más estable y fácil de formar que CH3·. ¿Por qué? Porque el radical CH3CH2· es primario, 1º, lo que significa que el electrón desapareado se encuentra sobre un átomo de carbono que está enlazado a otro carbono. Mientras, el CH3· nada más está enlazado a átomos de hidrógeno.
¿A qué se debe esto? Recordando la representación anterior, el electrón desapareado se localiza en un orbital p, perpendicular a los otros enlaces. En el CH3·, los átomos de hidrógeno apenas donan densidad electrónica al átomo de carbono, en un intento por compensar la falta de otro electrón.
En el CH3CH2·, por otra parte, el carbono con el electrón desapareado está enlazado a dos hidrógenos y a un grupo metilo. En consecuencia, este carbono recibe mayor densidad electrónica, lo cual ayuda a estabilizar un poco al electrón desapareado. La misma explicación es válida para otros radicales alquilos 1º.
En un radical alquilo secundario o 2º, como el radical isopropilo, (CH3)2C·, el electrón desapareado se ve todavía más estabilizado porque recibe densidad electrónica ahora de dos grupos carbonados. Por lo tanto, es más estable que los radicales 1º y metilo.
Tenemos también los radicales alquilos terciarios o 3º, como el radical ter-butilo, (CH3)3C·. Estos son más estables que el 1º y el 2º. Ahora, son tres grupos carbonados diferentes al átomo de hidrógeno los que estabilizan al electrón desapareado.
Cabe mencionar además los radicales alílico, CH2=CH-CH2·, y vinílico, CH2=CH·.
El alílico es el más estable de todos. Esto se debe a que el electrón desapareado es capaz inclusive de desplazarse al átomo de carbono del otro extremo. El vínilico, en cambio, es el más inestable de todos, ya que el grupo CH2=, más ácido, atrae densidad electrónica hacia sí en lugar de donarla hacia el carbono con el electrón desapareado.
En resumen, las estabilidades relativas de los radicales alquilos, de mayor a menor, son:
Alilo > 3º > 2º > 1º > vinilo
La nomenclatura de los radicales alquilo es la misma que para los grupos alquilo: se cambia la terminación –ano, del nombre del alcano, por la terminación –ilo. Así, el CH3CH2· se llama radical etilo; y el radical CH3CH2CH2CH3, n-butilo.
Los principales radicales alquilo coinciden con los grupos alquilo: son aquellos que poseen menos de seis átomos de carbono. Por lo tanto, los radicales alquilo derivados del metano, etano, propano, butano y pentano, son los más comunes. Asimismo, los radicales vinilos y alílicos forman parte de esta lista.
Otros radicales alquilos que se encuentran con menor frecuencia son los que derivan de los cicloalcanos, tales como el ciclopropilo, ciclobutano o ciclopentano.
En la siguiente imagen se representan varios de estos radicales con unas letras asignadas:
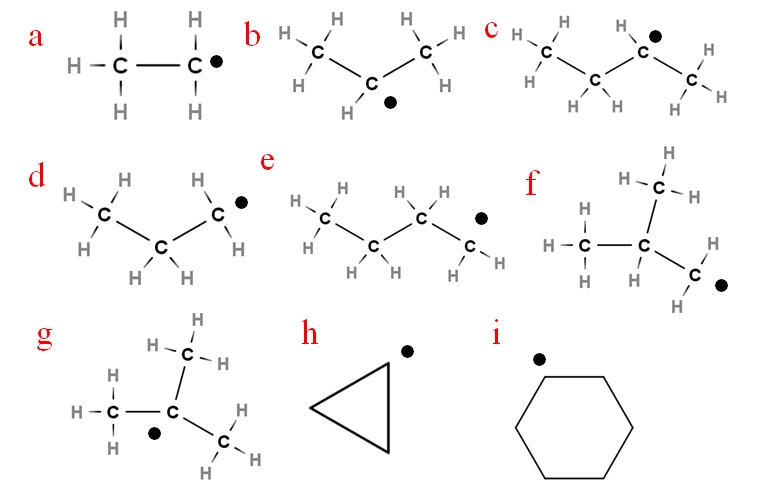
Empezando por la letra ‘a’, tenemos:
-a, radical etilo
-b, radical Isopropilo
-c, radical secbutilo
-d, radical propilo
-e, radical n-butilo
-f, radical isobutilo
-g, radical ter-butilo
-h, radical ciclopropilo
-i, radical ciclohexilo
Cada uno de estos radicales pueden tener o no sus hidrógenos sustituidos por otros grupos, por lo que son igual de variados como los alcanos y sus isómeros estructurales.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Alkyl. Recuperado de: en.wikipedia.org
- Chemistry LibreTexts. (05 de junio de 2019). Structure of Alkyl Radicals: Hyperconjugation. Recuperado de: chem.libretexts.org
