¿Qué son los orbitales degenerados?
Los orbitales degenerados son los que se encuentran en un mismo nivel de energía. De acuerdo a esta definición, deben tener el mismo número cuántico principal n. Así, los orbitales 2s y 2p son degenerados, ya que pertenecen al nivel energético 2, aunque se sabe que sus funciones de ondas angulares y radiales son diferentes.
A medida que aumentan los valores de n, los electrones comienzan a ocupar otros subniveles de energía, como los orbitales d y f.
Cada uno de estos orbitales tienen sus propias características, las cuales a primera vista se observa en sus formas angulares; estas son las figuras esféricas (s), de mancuernas (p), de hojas de tréboles (d) y globulares (f).
Entre ellos existe una diferencia energética, incluso perteneciendo al mismo nivel n.
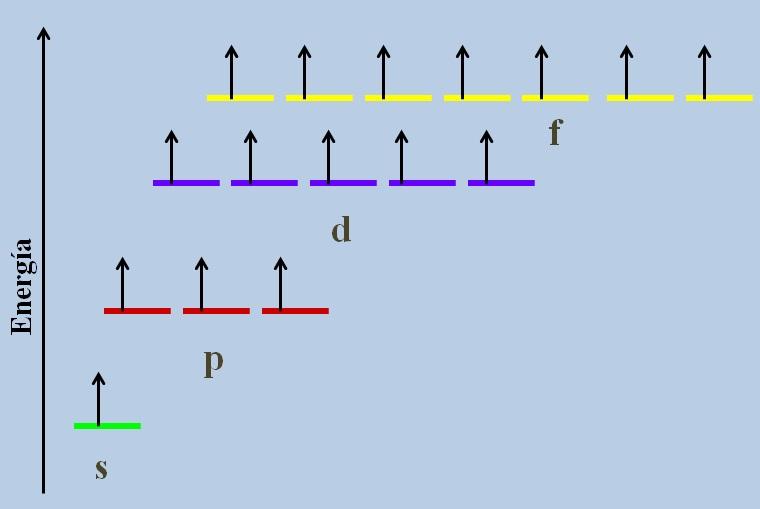
Por ejemplo, en la imagen superior se muestra un esquema de energía con los orbitales ocupados por electrones desapareados (un caso anormal).
Puede verse que de todos, el más estable (el de menor energía) es el orbital ns (1s, 2s,…), mientras que el nf es el más inestable (el de mayor energía).
Orbitales degenerados de un átomo aislado
Los orbitales degenerados, con un mismo valor de n, se encuentran en una misma línea en un esquema energético.
Por esta razón, las tres franjas rojas que simbolizan los orbitales p se ubican en una misma línea; como del mismo modo lo hacen las franjas moradas y amarillas.
El esquema de la imagen viola la regla de Hund: se llenan con electrones los orbitales de mayor energía sin aparearlos primero en los de menor energía.
Al aparearse los electrones, el orbital pierde energía, y ejerce una repulsión electrostática mayor sobre los electrones desapareados de los otros orbitales.
Sin embargo, tales efectos no se consideran en muchos diagramas energéticos. De ser así, y obedeciendo la regla de Hund sin llenar por completo los orbitales d, se vería que estos dejan de ser degenerados.
Como se dijo anteriormente, cada orbital cuenta con sus características propias. Un átomo aislado, con su configuración electrónica, tiene dispuestos sus electrones en el número preciso de orbitales que permitan alojarlos.
Solo aquellos iguales en energía pueden considerarse como degenerados.
Orbitales p
Las tres franjas rojas para los orbitales p degenerados de la imagen señalan que tanto px, py y pz poseen la misma energía.
Hay un electrón desapareado en cada uno, descrito por cuatro números cuánticos (n, l, ml y ms), mientras que los tres primeros describen a los orbitales.
La única diferencia entre ellos viene denotada por el momento magnético ml, el cual dibuja la trayectoria de px sobre un eje x, py sobre el eje y, y pz en el eje z.
Los tres son iguales, pero difieren únicamente en sus orientaciones espaciales. Por esta razón se dibujan siempre alineados en energía, es decir, degenerados.
Como son iguales, un átomo aislado de nitrógeno (con configuración 1s22s22p3) debe mantener degenerados sus tres orbitales p. No obstante, el escenario energético cambia abruptamente si se considera un átomo de N dentro de una molécula o compuesto químico.
Es así porque si bien px, py y pz son iguales en energía, esta puede variar en cada uno de ellos si poseen distintos entornos químicos; es decir, si se enlazan a átomos diferentes.
Orbitales d
Las cinco franjas moradas denotan los orbitales d. En un átomo aislado, aun si tienen electrones apareados, se consideran que estos cinco orbitales son degenerados. Sin embargo, al contrario de los orbitales p, esta vez sí hay una marcada diferencia en sus formas angulares.
Por lo tanto, sus electrones recorren direcciones en el espacio que varían de un orbital d a otro.
Esto ocasiona, según la teoría del campo cristalino, que una mínima perturbación ocasione un desdoblamiento energético de los orbitales; esto es, las cinco franjas moradas se separan dejando una brecha energética entre ellas:
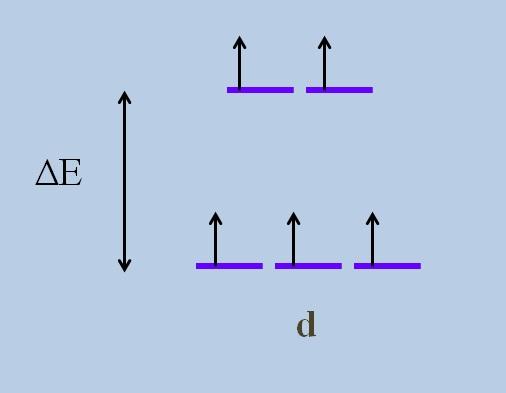
¿Cuáles son los orbitales de arriba y cuáles los de abajo? Los de arriba se simbolizan como eg, y los de abajo t2g.
Nótese cómo inicialmente todas las franjas moradas estaban alineadas, y ahora se formó un conjunto de dos orbitales eg más energéticos que el otro conjunto de tres orbitales t2g.
Esta teoría permite explicar las transiciones d-d, a las cuales se les adjudican muchos de los colores observados en los compuestos de los metales de transición (Cr, Mn, Fe, etc.).
Esta perturbación electrónica se debe a las interacciones de coordinación del centro metálico con otras moléculas denominadas ligandos.
Orbitales f
Y con los orbitales f, las siete franjas amarillas, la situación se complica aún más. Sus direcciones espaciales varían mucho entre ellos, y la visualización de sus enlaces se vuelve demasiado compleja.
De hecho, se considera que los orbitales f son de una capa tan interna que no “participan apreciablemente” en la formación de enlaces.
Cuando el átomo aislado con orbitales f se rodea de otros átomos, comienzan las interacciones y ocurre el desdoblamiento (la pérdida de la degeneración):
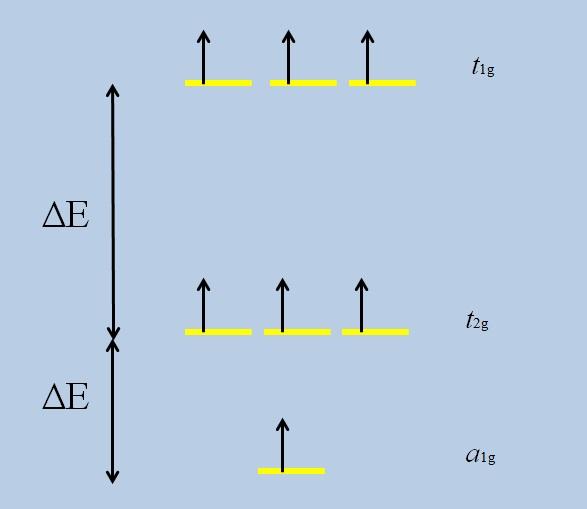
Nótese que ahora las franjas amarillas forman tres conjuntos: t1g, t2g y a1g, y que ya no son degeneradas.
Orbitales híbridos degenerados
Se ha visto que los orbitales pueden desdoblarse y perder la degeneración. Sin embargo, aunque esto explique las transiciones electrónicas, no esclarece cómo y por qué hay diferentes geometrías moleculares. Aquí entran los orbitales híbridos.
Su principal característica es que son degenerados. Así, surgen de la mezcla de caracteres de orbitales s, p, d y f, para originar híbridos degenerados.
Por ejemplo, tres orbitales p se mezclan con uno s para dar cuatro orbitales sp3. Todos los orbitales sp3 son degenerados, y, por tanto, tienen la misma energía.
Si adicionalmente se mezclan dos orbitales d con los cuatro sp3, se obtendrá seis orbitales sp3d2.
¿Y cómo explican las geometrías moleculares? Como son seis, con iguales energías, deben en consecuencia orientarse simétricamente en el espacio para generar entornos químicos iguales (por ejemplo, en un compuesto MF6).
Cuando lo hacen, se forma un octaedro de coordinación, lo que es igual a una geometría octaédrica en torno a un centro (M).
No obstante, las geometrías suelen presentar distorsiones, lo que significa que realmente ni siquiera los orbitales híbridos son completamente degenerados.
Por lo tanto, a modo de conclusión, los orbitales degenerados solo existen en átomos aislados o en entornos altamente simétricos.
Referencias
- Definition of Degenerate. Recuperado de: chemicool.com
- Atoms and Atomic Orbitals. Recuperado de sparknotes.com
- Whitten, Davis, Peck & Stanley. Química. (8.ª ed.). CENGAGE Learning.
