Hidrocarburos cíclicos: estructura, propiedades, ejemplos
Los hidrocarburos cíclicos son compuestos orgánicos que constan de átomos de carbono e hidrógeno que se enlazan para originar anillos o estructuras cíclicas. Los hay principalmente de tres tipos: alicíclicos, aromáticos y policíclicos.
Estos tipos de hidrocarburos pueden consistir entonces de las versiones cerradas de los alcanos, alquenos y alquinos; tener anillos con sistemas aromáticos, como el benceno y sus derivados; o presentar estructuras intrincadas y fascinantes. De todos ellos los alicíclicos son los más simples, y suelen representarse mediante el uso de polígonos.
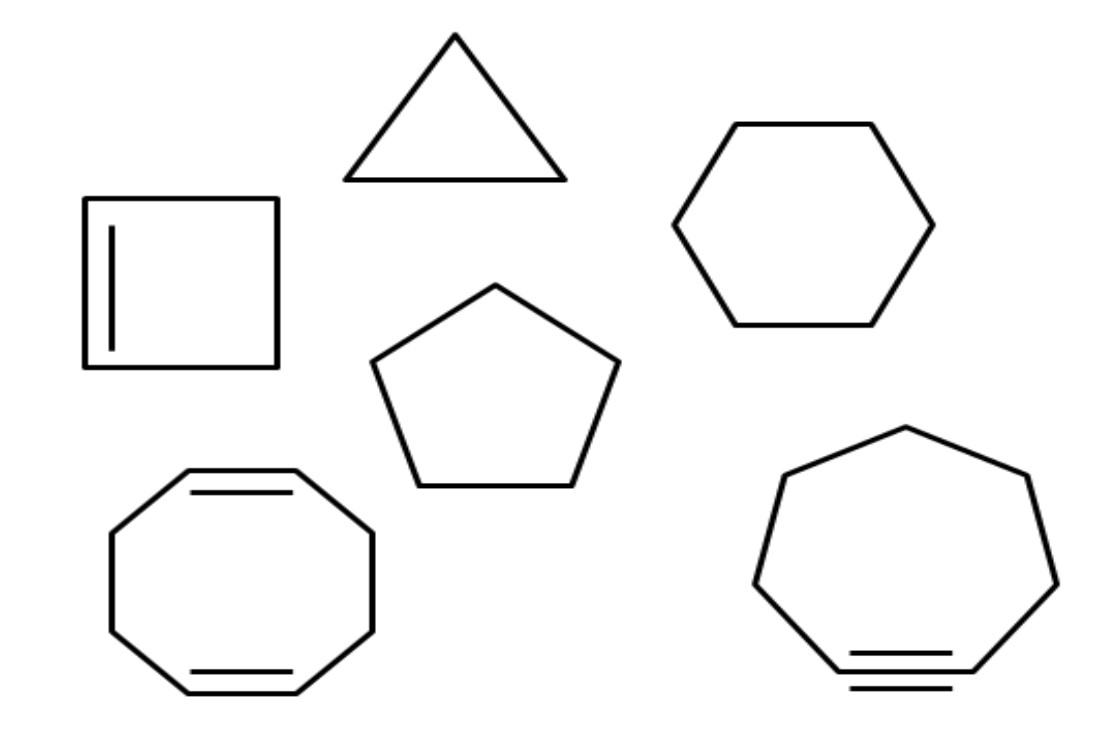
Arriba por ejemplo se tienen varios hidrocarburos alicíclicos. Parecen simples polígonos: un cuadrado, triángulo, pentágono, hexágono, etc. Si se pudieran cortar con una tijera uno de sus enlaces C-C, el resultado sería un alcano, alqueno (si tiene dobles enlaces) o alquino (si tiene triples enlaces).
Sus propiedades no difieren demasiado de los hidrocarburos de cadena abierta de los cuales proceden; aunque, químicamente, cuanto más grandes sean, más estables serán, y su interacción con un medio molecular se torna más pronunciada (por su mayor área de contacto).
Índice del artículo
Yendo directo al asunto que concierne a sus estructuras, debe aclararse que estas no son planas, aun cuando en su representación de polígonos así lo parezcan. La única excepcion a esta aseveración se encuentra en el ciclopropano (el triángulo), ya que sus tres puntos obligatoriamente deben descansar sobre un mismo plano.
También es necesario aclarar que los términos ‘ciclos’ y ‘anillos’ son a menudo intercambiables; un anillo no tiene por qué ser circular, y por tanto puede adquirir un sinfín de geometrías con tal de que sea una estructura cerrada. Se dice entonces que el ciclopropano tiene un anillo o ciclo triangular.
Todos los carbonos tienen hibridaciones sp3, por lo que sus geometrías son tetraédricas y sus enlaces deben estar idealmente separados por un ángulo de 109,5°; sin embargo, esto no es posible para estructuras tan cerradas como las del ciclopropano, ciclobutano (cuadrado), o ciclopentano (pentágono).
Se habla entonces de una tensión que desestabiliza la molécula, y se determina experimentalmente por la medición de los calores de combustión promedio de cada grupo CH2.
¿Y qué pasa cuando hay dobles o triples enlaces? La tensión se incrementa, porque donde haya uno de ellos, la estructura se verá obligada a “encogerse” y mantenerse plana; lo que, consecutivamente, forzaría una conformación por encima de otras, eclipsando probablemente átomos vecinos de hidrógeno.
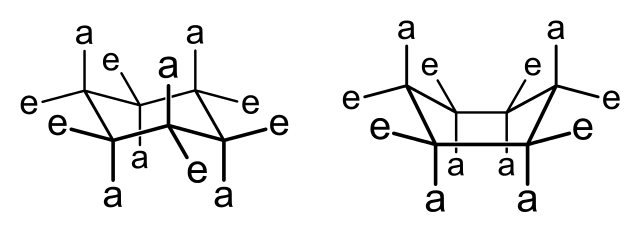
En la imagen superior se muestran dos confórmeros para el ciclohexano para intentar explicar lo anterior dicho. Los átomos que están en las posiciones a o e se dicen que son axiales o ecuatoriales, respectivamente. Nótese que en lugar de un hexágono plano, se tiene una silla (izquierda) y un bote (derecha).
Estas estructuras son dinámicas y establecen un equilibrio entre ellas. Si los átomos en a son muy voluminosos, el anillo se “acomodará” para posicionarlos en las posiciones ecuatoriales; ya que allí se orientan hacia los lados del anillo (lo cual reforzaría o perjudicaría las interacciones intermoleculares).
Si observamos cada carbono por separado, se verá que son tetraédricos. Esto no sería así si hubiera un doble enlace: sus hibridaciones sp2 forzarían a la estructura a aplanarse; y de haber un triple enlace, a alinearse. La estructura plana del benceno es la máxima representación de esto.
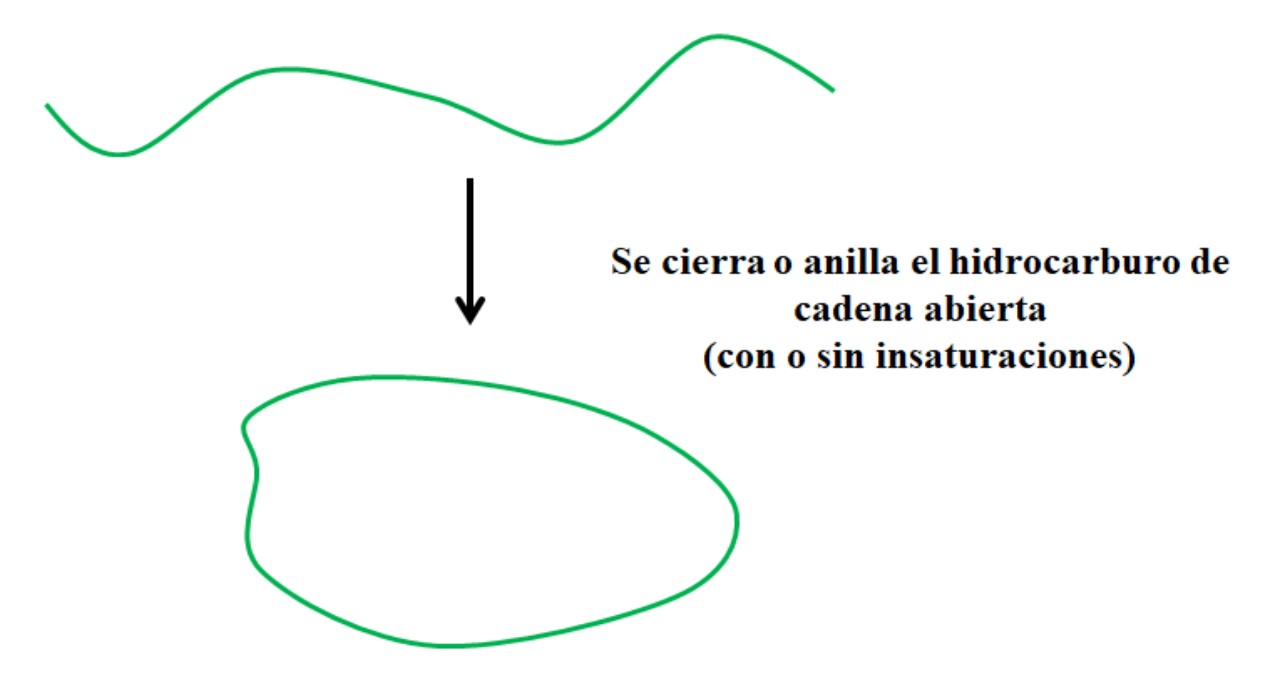
Supóngase que se tiene un hidrocarburo de cadena abierta (con o sin insaturaciones o ramificaciones). Si pudiéramos unir sus extremos, se crearía un anillo o ciclo (tal como en la imagen superior).
Desde la óptica de síntesis orgánicas, esto no acontece así no más; debe haber buenos grupos salientes enlazados en los extremos de la cadena, que al salir, promueven que se cierre la cadena (si la disolución está muy diluida).
Con esto en mente, puede verse que el hidrocarburo de trazo verde solo sufre una transformación respecto a su estructura; sin el rompimiento o adición de nuevos enlaces con otros átomos. Quiere decir, que químicamente continúa siendo el mismo antes y después de cerrarse o anillarse.
Por lo tanto, las propiedades químicas o físicas de estos hidrocarburos alicíclicos no difieren demasiado de las de sus homólogos de cadena abierta. Ambos son reactivos frente a las mismas especies (a decir, halógenos bajo luz utravioleta), y pueden sufrir fuertes oxidaciones o combustionar liberando calor.
Hay un hecho innegable: el anillo tiene mayor área de contacto que la cadena abierta, y por tanto sus interacciones intermoleculares son más fuertes.
El resultado es que sus puntos de ebullición y fusión tienden a ser mayores, al igual que sus densidades. Otras tantas diferencias pueden notarse en sus índices de refracción o presiones de vapor.
Regresando al ejemplo del hidrocarburo de trazo verde, su nomenclatura permanece inalterada una vez se haya cerrado sobre sí mismo (como una serpiente que muerde su propia cola). Por lo tanto, las reglas de nomenclatura siguen siendo las mismas; a menos que se aborden los hidrocarburos policíclicos o aromáticos.
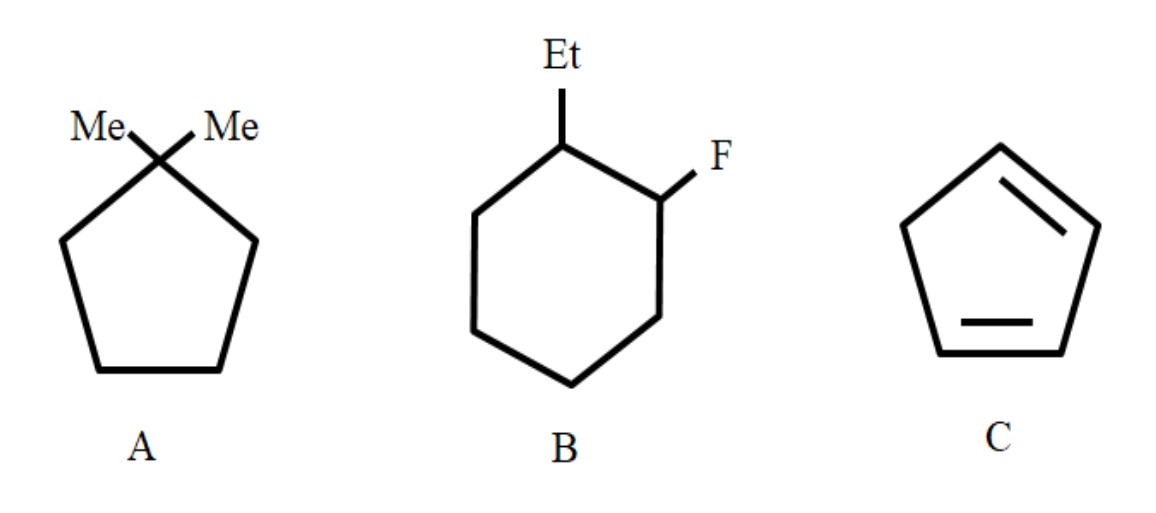
Se muestra a continuación tres compuestos, a los cuales se les darán sus nombres apropiados:
Para empezar, al tratarse de estructuras cerradas se utiliza el prefijo ciclo para referirse a ellos (aquí la palabra anillo queda relegada).
De izquierda a derecha tenemos: un ciclopentano, un ciclohexano, y otro ciclopentano. Se enumeran los carbonos de tal modo que se les asignen a los sustituyentes los números menores, y se mencionan además en orden alfabético.
Siendo así, A viene a ser: 1,1-Dimetilciclopentano. En B se comienza mencionando al sustituyente etilo antes que el flúor, por lo que su nombre es: 1-etil-2-fluorciclohexano. Y luego para C, los dobles enlaces se toman como sustituyentes, debiéndose indicar el número de los carbonos que lo forman: 1,3-ciclopentadieno.
A lo largo del artículo se ha hecho mención de varios hidrocarburos cíclicos. En la primera imagen pueden encontrarse: ciclopropano, ciclobutano, ciclopentano, ciclohexano, cicloheptano y ciclooctano.
De ellos puede obtenerse una amplia gama de derivados, y basta con colocarles dobles o triples enlaces para tener cicloalquenos o cicloalquinos, respectivamente. Y respecto a los hidrocarburos aromáticos, basta con tener en mente el anillo bencénico y sustituirlo o reproducirlo en dos dimensiones.
Sin embargo, los más extraordinarios (y problemáticos a la hora de comprender su nomenclatura) son los hidrocarburos policíclicos; es decir, no basta con simples polígonos siquiera para representarlos de manera sencilla. Tres de ellos dignos de mención son: cubano, canastano y pagodano (imágenes inferiores).
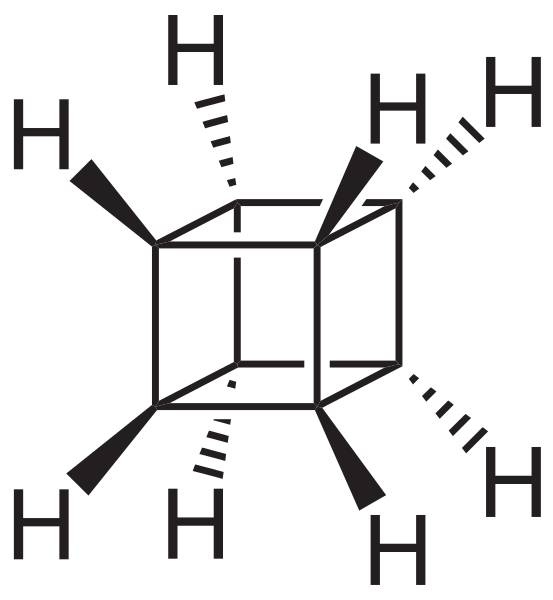
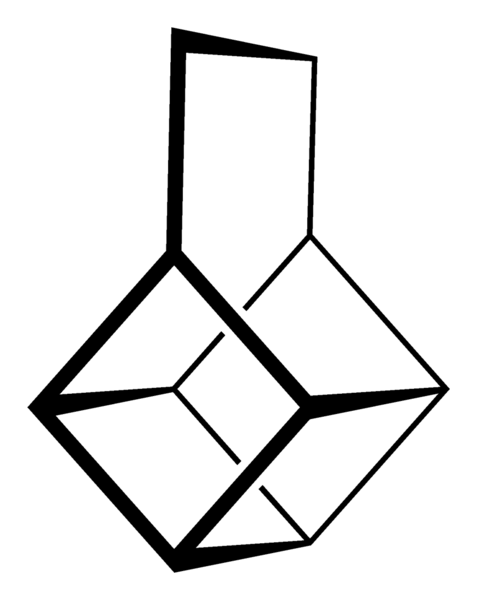
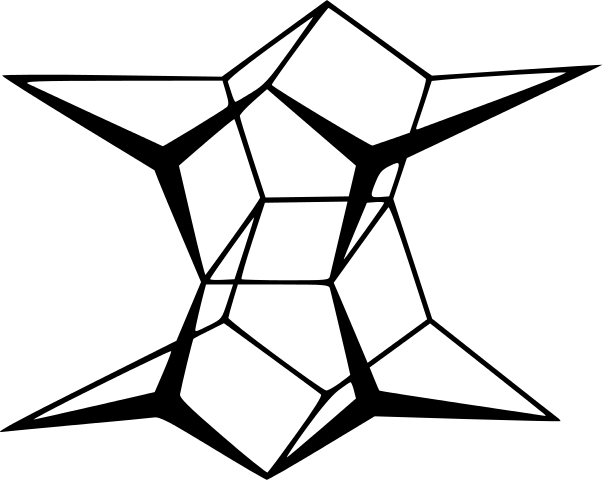
Cada uno de ellos tiene su compleja metodología de síntesis, su historia, arte, y una latente fascinación por las infinitas posibilidades estructurales a las que pueden llegar unos simples hidrocarburos.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Reid Danielle. (2019). Cyclic Hydrocarbons: Definition & Example. Study. Recuperado de: study.com
- CK-12 Foundation. (05 de junio de 2019). Cyclic Hydrocarbons. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Wikipedia. (2019). Cyclic compound. Recuperado de: en.wikipedia.org
- Vaquero Miguel. (2019). Hidrocarburos cíclicos. Recuperado de: deciencias.net
