Estaño: estructura, propiedades, obtención, usos
El estaño es un metal perteneciente al bloque p de la tabla periódica, cuyo símbolo químico es Sn, y que se ubica en el grupo 14, el del carbono. A pesar de ser un metal muy usado a lo largo de la humanidad desde tiempos remotos, lo cierto es que es un metal escaso en la corteza terrestre (2.3 ppm).
Es un metal plateado, blando, dúctil y maleable. Tiene un número atómico de 50, y sus estados o números de oxidación predominantes son +2 (Sn2+) y +4 (Sn4+), siendo los compuestos de estaño (II), como el SnCl2, buenos agentes reductores.

El estaño tiene como símbolo Sn, el cual es una abreviatura de la palabra latina “stannum”. El estaño es un metal resistente al ataque del agua y del aire a temperatura ambiente; pero en el aire caliente forma dióxido de estaño, SnO2.
La propiedad de ser resistente a la corrosión, y tener un bajo punto de fusión, ha servido para que el estaño tenga numerosas aplicaciones; tales como el recubrimiento de superficies de metales y la soldadura.
El estaño tiene dos formas alotrópicas principales: la forma β de color blanco y sólido; y la forma α, de color gris y de contextura normalmente polvorienta (más quebradiza). Por lo tanto, la forma β es la más usada en las aplicaciones del estaño.
Otra propiedad importante del estaño es su capacidad de formar parte de aleaciones con varios metales, siendo la más antigua el bronce, una aleación de cobre y estaño.
Índice del artículo
- 1 Descubrimiento
- 2 Estructura química del estaño
- 3 Configuración electrónica
- 4 Propiedades del estaño
- 5 Obtención
- 6 Usos/aplicaciones
- 7 Referencias

El estaño es un metal que es conocido desde la antigüedad. Por lo tanto, no se conoce quién fue su descubridor; y mucho menos, el año y el lugar de su descubrimiento.
El bronce es una aleación del cobre con el estaño y el arsénico. Es posible que la elaboración de esta aleación sea consecuencia de un hecho fortuito y no intencional, ya que los primeros objetos de bronce -en la Edad de Bronce- estaban formados por cobre y solo trazas de arsénico.
Estos objetos aparecieron en el Cercano Oriente donde el arsénico se encuentra asociado al cobre. Pero desde un principio se evidenció la toxicidad del arsénico, lográndose su sustitución por el estaño en el bronce, usándose principalmente como fuente de estaño la casiterita (SnO2).
Los antiguos griegos obtenían el estaño por el comercio marítimo y se referían a la fuente de su estaño como “Las Cassiterides” que significa ‘islas de estaño’. Es posible que estas islas estuvieran ubicadas en Cornuelles, territorio británico o de España, donde hay grandes depósitos de estaño.
Al haber dos alótropos: el estaño blanco o β-Sn, y el estaño grisáceo o α-Sn, tendremos dos estructuras cristalinas. La del β-Sn es tetragonal centrado en el cuerpo (bct), la cual caracteriza la maleabilidad del estaño blanco.
Mientras, la estructura del α-Sn es de tipo diamante; es decir, los átomos Sn se enlazan formando redes de tetraedros, sin la existencia propiamente de un enlace metálico en absoluto.
El estaño también presenta otros dos alótropos bajo diferentes condiciones de presión (en el orden de los GPa) y temperatura (por encima de los 161 ºC): σ-Sn y γ-Sn.
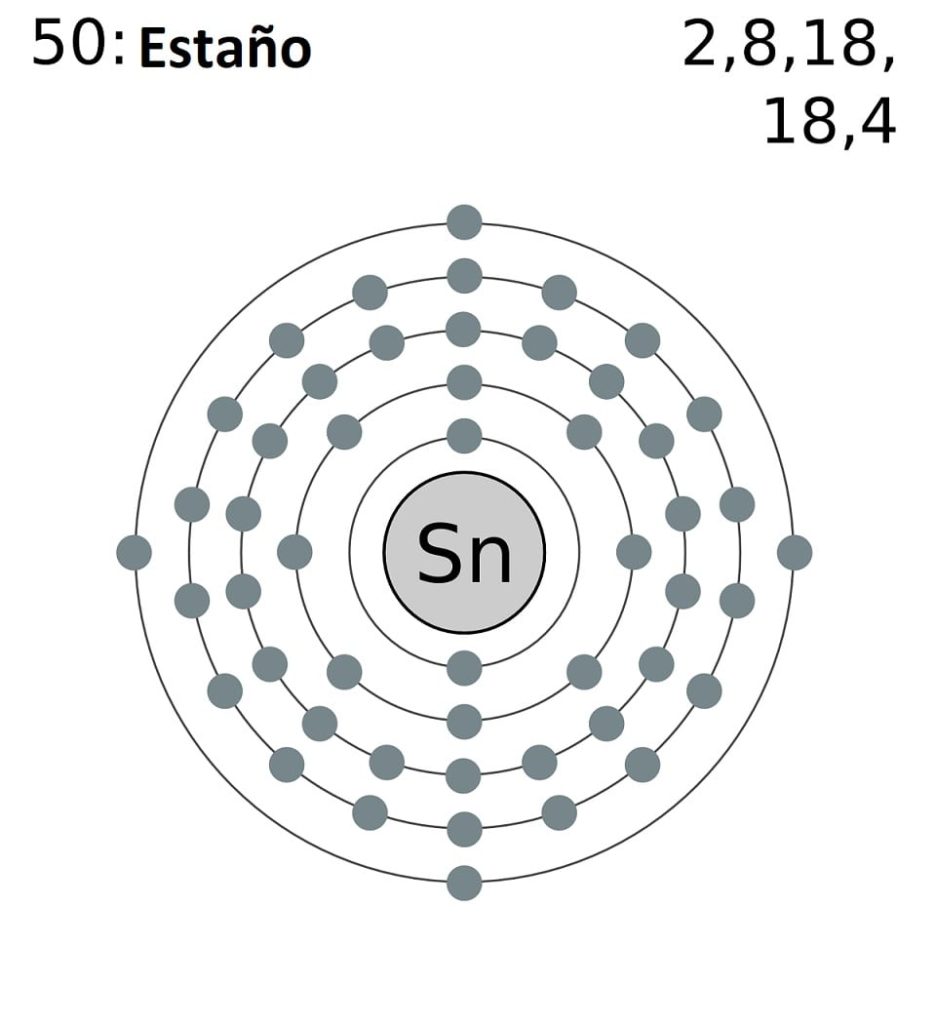
La configuración electrónica abreviada del estaño es la siguiente:
[Kr] 4d10 5s2 5p2
Sumando todos los electrones tendremos un total de 14, el mismo número que corresponde a su grupo. Sin embargo, solo los electrones de los orbitales 5s y 5p son los que participan en las reacciones químicas del estaño, pues los del 4d no están energéticamente disponibles.
El estaño es un metal blando, dúctil y maleable, que en frío puede ser laminado e hilado. Su bajo punto de fusión permite que se adhiera a las superficies limpias de metales o aleaciones como el acero, el cobre y sus aleaciones, protegiéndolos así de la oxidación.
Cuando una pieza de estaño se dobla cruje, emitiendo un sonido característico conocido como el “grito del estaño”, consecuencia del aplastamiento de los cristales.
El estaño presenta dos formas alotrópicas: la β y la α. La forma β corresponde a un sólido blanco y es responsable de las aplicaciones del estaño; mientras que la forma α es un polvo grisáceo.
La forma β se presenta a temperaturas superiores a 13.2 ºC. Cuando la temperatura desciende de 13.2 ºC, el estaño cambia de la forma β a la forma α. Este fenómeno es indeseable y se evita añadiendo al estaño otros metales, como el antimonio o el bismuto, los cuales bloquean este cambio y prolongando su vida útil.
El estaño es el primer superconductor conocido a temperaturas por debajo de 3.72 K.
50
118.71 g/mol
231.93 ºC
2602 ºC
Alótropo β: 7.265 g/cm3
Alótropo α: 5.769 g/cm3
El estaño tiene múltiples estados de oxidación: -4, -3, -2, -1, 0, +1, +2, +3, +4. Sin embargo, la mayor parte de sus compuestos tienen al estaño con estados de oxidación +2 (Sn2+) y +4 (Sn4+).
Primera: 708.6 KJ/mol
Segunda: 1411.8 kJ/mol
Tercera: 2943.0 kJ/mol
1.96 en la escala Pauling
El estaño es un metal resistente a la acción del aire y del agua a temperatura ambiente, pero cuando se calienta en el aire forma el óxido de estaño (IV), SnO2, el cual es débilmente ácido. Es atacado por los ácidos y los álcalis, y en presencia de oxígeno puede actuar en algunos casos como catalizador.

El estaño, desde el punto de vista de su ocurrencia, es un metal raro, ya que tiene una abundancia en la corteza terrestre de apenas 2 ppm. El mineral casiterita, un mineral de óxido de estaño, es la única fuente comercial del estaño.
La casiterita es un mineral negruzco que se encuentra en terrenos fangosos en las orillas de los ríos. El estaño es extraído de la casiterita mediante su calentamiento hasta 1370 ºC con carbón o coque para producir su reducción.
El estaño producido es impuro, por lo que se trata con hidróxido de sodio o ácido clorhídrico para solubilizar el estaño. Luego, este es sometido a electrólisis, siendo el ánodo de estaño y el cátodo de hierro. El estaño se deposita sobre el cátodo, con una pureza superior al 90%.
El estaño es un metal resistente a la corrosión. La llamada lata u hojalata es un envase de acero, recubierto con una capa de estaño para evitar su oxidación.
Las latas han sido utilizadas para almacenar alimentos y otras sustancias, por ejemplo: pinturas, lacas, solventes, etc. Pero actualmente están siendo sustituidas por envases de aluminio o plástico. Las tuberías y válvulas recubiertas de estaño mantienen la pureza del agua y las bebidas.

El hombre comenzó a usar el bronce desde hace más de 5000 años. El bronce es una aleación de cobre y estaño que se usa en la elaboración de herramientas, armas, utensilios del hogar.
De la misma forma el peltre, una aleación que inicialmente era de estaño y plomo, se utilizó para hacer ollas, platos, etc. Pero debido a la toxicidad del plomo, se fabrica actualmente el peltre con la aleación de estaño, antimonio y cobalto.
La aleación del estaño y el plomo tiene un bajo punto de fusión, propiedad que ha permitido su uso en la soldadura, técnica que sirve para juntar piezas presentes en circuitos eléctricos y electrónicos. Hay piezas de automóviles en las cuales el estaño es aleado con hierro, mientras que se usan en vehículos aeroespaciales aleaciones de aluminio, estaño y titanio.
Las aleaciones de circonio, también denominadas Zircaloys, son utilizadas en los reactores nucleares y tienen una pequeña cantidad de estaño.

La aleación de la plata y el estaño ha sido utilizada en amalgamas dentales.
Una aleación cristalina con el elemento niobio es un superconductor que funciona a temperatura de 18 K y mantiene su propiedad en un fuerte campo magnético.
El estaño se utiliza en el procedimiento de Pilkington para producir vidrios para ventanas. El vidrio fundido es colocado sobre una superficie de estaño fundido, adquiriendo el vidrio una superficie plana y lisa. Esta técnica se sigue usando exitosamente.
Sales de estaño se rocían sobre el vidrio para obtener un revestimiento conductor de la electricidad, pudiéndose utilizar para hacer paneles de iluminación y parabrisas sin escarcha.
El cloruro estañoso (SnCl2) se utiliza en el galvanizado de estaño y como agente reductor en la fabricación de polímeros y tintes. El fluoruro de estaño (SnF2) es un ingrediente activo en las pastas dentales.
Mientras, su óxido es un catalizador útil en ciertos procesos industriales. Además, se usa como polvo para pulir acero.
Los compuestos orgánicos de estaños se usan como biocidas y fungicidas, siendo tóxicos para los seres humanos. Los estabilizadores orgánicos de estaño se utilizan para prevenir cambios en el cloruro de polivinilo por la exposición a la luz y al calor.
El cloruro estáñico (SnCl4) es usado como estabilizador de perfumes y como material de partida para otras sales de estaño.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Tin. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information (2020). Tin. PubChem Compound Summary for CID 23974. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2020). Tin Element Facts. Recuperado de: chemicool.com
- The Editors of Encyclopaedia Britannica. (2020). Tin. Recuperado de: britannica.com
- Bell, Terence. (26 de agosto de 2020). The Properties, Production, and Applications of Tin. Recuperado de: thoughtco.com
- Lenntech B.V. (2020). Tin. Recuperado de: lenntech.com
- Stephanie Pappas. (28 de julio de 2015). Facts About Tin. Recuperado de: livescience.com
- AIP Conference Proceedings. (09 de febrero de 2018). Tin recovery from tin slag using electrolysis method. doi.org/10.1063/1.5024070
