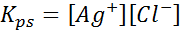Ley de acción de masas: qué es, explicación y ejemplos

¿Qué es la ley de acción de masas?
La ley de acción de masas establece que la velocidad de una reacción depende de la concentración de sus reactantes elevadas a sus coeficientes estequiométricos. Esta ley permite relacionar entre sí las concentraciones en el equilibrio de los reactantes y productos de una reacción química reversible. En otras palabras, establece la fórmula de la constante de equilibrio.
La ley de acción de masas la enunciaron los químicos noruegos (y además cuñados) Cato M. Guldberg (1836-1902) y Peter Waage (1833-1900) en 1864. Esta es una de las leyes fundamentales de la química, ya que nos permite calcular las concentraciones finales en el equilibrio a partir de las cantidades iniciales.
Además de esto, la ley de acción de masas también nos permite entender de forma sencilla los efectos que tienen los cambios en las concentraciones de cualquiera de las especies sobre el equilibrio. En otras palabras, nos permite entender cómo funcionan los principios de Le Chatelier.
A pesar de llamarse “ley de acción de masas”, en realidad no se refiere a las masas de los reactantes y productos, sino, más bien, a sus concentraciones. La razón por la que se llama ley de acción de masa y no ley de acción de concentraciones es porque a la concentración se le solía llamar “masa activa”.
La ley de acción de masas y la constante de equilibrio
Según la ley de acción de masas, cuando las reacciones reversibles alcanzan el equilibrio no es porque la reacción se detenga. Por el contrario, el equilibrio se alcanza cuando la velocidad de la reacción directa se hace igual a la velocidad de la reacción inversa. Cuando eso sucede, todas las especies químicas se producen y se consumen a la misma velocidad, por lo que sus concentraciones se vuelven constantes (dejan de cambiar).
Guldberg y Waage descubrieron que las velocidades de ambas reacciones (la directa y la inversa) dependen de la concentración molar (en mol/L) de sus reactivos elevados a los coeficientes estequiométricos. A partir de esas observaciones lograron encontrar la fórmula para la constante de equilibrio.
Según esta ley, para cualquier reacción química reversible que alcanza el equilibrio,
“…la relación entre el producto de las concentraciones molares de los productos elevados a sus coeficientes estequiométricos y el producto de las concentraciones molares de los reactantes elevadas a sus coeficientes estequiométricos es constante a una temperatura determinada.”
A dicha constante se le denomina “constante de equilibrio” y se representa con el símbolo Kc.
La fórmula de la constante de equilibrio
Veamos cómo se ve el enunciado anterior en forma de una ecuación matemática. Sea una reacción química reversible cualquiera como la que se presenta a continuación, donde A y B son los reactantes, C y D los productos, y a, b, c y d son los respectivos coeficientes estequiométricos de la reacción balanceada:
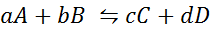
Para una reacción genérica como esta, la constante de equilibrio viene dada por:
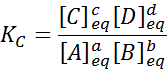
donde [A], [B], [C] y [D] son las concentraciones molares de A, B, C y D en el equilibrio.
La constante de equilibrio en presiones
La fórmula anterior para la constante de equilibrio se aplica a cualquier reacción química en la que todas las sustancias estén en la misma fase (es decir, que todas estén en fase acuosa, o en fase gaseosa, por ejemplo). Sin embargo, para el caso de las reacciones en fase gaseosa, es más conveniente trabajar con presiones que con concentraciones.
Como la concentración molar de los gases es proporcional a su presión parcial, entonces la fórmula de la constante de equilibrio se puede reescribir en términos de dichas presiones, de la siguiente manera:
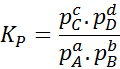
Donde pA, pB, pC y pD son las presiones parciales de A, B, C y D respectivamente, y a, b, c y d siguen siendo los coeficientes estequiométricos. En este caso, KP se denomina constante de equilibrio en presiones, y está relacionada con KC por medio de la siguiente fórmula:
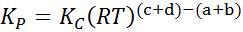
donde R es la constante universal de los gases ideales y T es la temperatura absoluta en Kelvin.
Reacciones que involucran más de una fase
A veces, una reacción química involucra la formación de un sólido como un precipitado a partir de una solución, o la formación de un líquido a partir de reactantes que reaccionan en fase gaseosa. En estos casos, la reacción no está ocurriendo toda en una misma fase, por lo que debemos modificar la fórmula de la constante de equilibrio.
Afortunadamente, las modificaciones son muy sencillas. Lo único que debemos tomar en cuenta a la hora de escribir la fórmula de la constante de equilibrio es que las sustancias puras que aparecen como sólidos o líquidos no las debemos tomar en cuenta. De ser necesario, en su lugar colocamos un 1.
En conclusión, la ley de acción de masas permite escribir la fórmula de la constante de equilibrio tanto en concentraciones como en presiones parciales. Al conocer una de las dos, la otra la podemos hallar a partir de la primera.
Finalmente, debemos tener cuidado y revisar la fase en la que se encuentren todas las especies químicas, para saber si las debemos incluir o no en la constante de equilibrio.
Ejemplos del uso de la ley de acción de masas
En los siguientes ejemplos mostramos cómo utilizar la ley de acción de masas para escribir las fórmulas de las constantes de equilibrio para diferentes tipos de reacciones químicas.
Equilibrios de reacciones en estado gaseoso
Ejemplo 1: La descomposición del N2O4 en fase gaseosa
El N2O4 es un gas marrón que se descompone según la siguiente reacción:
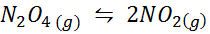

Para esta reacción, las constantes de equilibrio en concentraciones y presiones vienen dadas por:
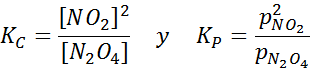
Ejemplo 2: La oxidación del monóxido de carbono
El monóxido de carbono es un gas muy tóxico que puede convertirse en dióxido de carbono al reaccionar con oxígeno según la siguiente reacción:
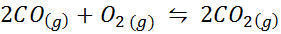
Para esta reacción, las constantes de equilibrio en concentraciones y presiones vienen dadas por:
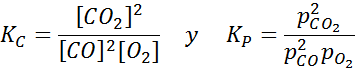
Equilibrios ácido-base en fase acuosa
Ejemplo 3: La autoprotólisis del agua
El equilibrio iónico del agua, también conocido como la reacción de autoprotólisis del agua, es una reacción reversible entre dos moléculas de agua en estado líquido. La reacción es:
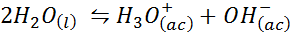
Al escribir la constante de equilibrio para esta reacción, debemos tomar en cuenta que, en este caso, el único reactivo es un líquido puro cuya concentración es prácticamente constante. Por esta razón, no se incluye en la fórmula de la constante de equilibrio:
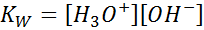
Esta es una constante de equilibrio muy importante que recibe su propio nombre (constante del producto iónico del agua) y su propio símbolo (KW. La W se refiere a agua en inglés, que se dice water). Sin embargo, es una constante de equilibrio en concentraciones como cualquier otra.
Equilibrios de solubilidad
Ejemplo 4: El equilibrio de solubilidad del cloruro de plata
Cuando preparamos una solución saturada se establece un equilibrio de solubilidad. En este caso, el equilibrio es el de la disolución del cloruro de plata, cuya reacción viene dada por:
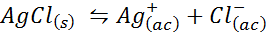
La constante de equilibrio de esta reacción (y de todas las reacciones de disolución) no incluye al cloruro de plata (AgCl) ya que es un sólido. Además, al igual que en el caso del agua, estas constantes también reciben un nombre especial que es “constante del producto de solubilidad”, representado como Kps: