Prueba de la catalasa: fundamento, técnica y usos
La prueba de la catalasa es una metodología usada en los laboratorios de bacteriología para poner en evidencia la presencia de la enzima catalasa en aquellas bacterias que la poseen. Junto a la coloración de Gram son las principales pruebas que se le deben realizar a los microorganismos recién aislados. Estas pruebas orientan al microbiólogo sobre los pasos a seguir para la identificación definitiva del microorganismo en cuestión.
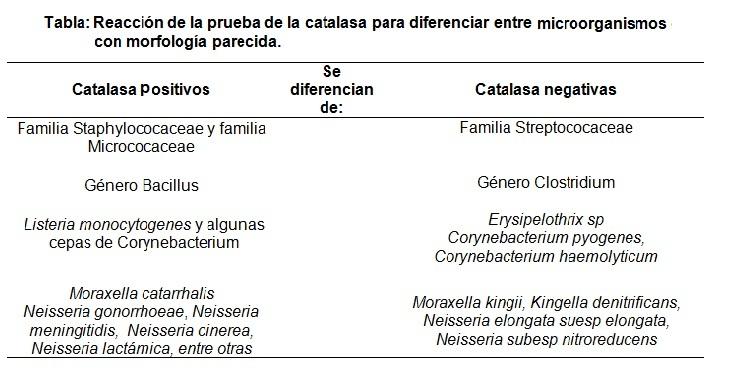
Por lo general las bacterias que contienen citocromo poseen la enzima catalasa, es decir, que las bacterias aerobias y anaerobias facultativas deberían poseerla. Sin embargo, existen excepciones, como por ejemplo los Streptococcus, que a pesar de ser microorganismos anaerobios facultativos no poseen la enzima catalasa.

Es por ello que la prueba de la catalasa se usa principalmente para distinguir a las familias Staphylococaceae y Micrococaceae (ambas catalasa positivas) de la familia Streptococaceae (catalasa negativa).
Así mismo, el género Bacillus (catalasa positiva) se distingue del género Clostridium (catalasa negativo), entre otros.
Índice del artículo
- 1 Fundamento
- 2 Técnica de rutina para la prueba de la catalasa
- 3 Prueba de la catalasa para especies de Mycobacterium
- 4 Uso
- 5 Control de calidad
- 6 Limitaciones
- 7 Referencias
La catalasa es una enzima clasificada como una hidroperoxidasa, esto quiere decir que utilizan como sustrato al peróxido de hidrógeno (H2O2).
También se le considera una oxidorreductasa, ya que en la reacción donde participa hay un elemento que sirve como donante de electrones (sustancia reductora) y otro como receptor de electrones (sustancia oxidante).
La catalasa es una proteína que contiene un grupo prostérico con cuatro átomos de hierro trivalentes (Fe+++), por tanto es una homoproteína. El ión férrico se mantiene oxidado durante la reacción.
Se puede decir que la catalasa es una enzima desintoxicante, pues su función es eliminar sustancias que se producen durante el metabolismo bacteriano que son tóxicas para las bacterias. Entre estas sustancias se encuentra el peróxido de hidrógeno.
El peróxido de hidrógeno se forma de la descomposición de los azúcares por la vía aeróbica. Este proceso ocurre de la siguiente manera:
El ión superóxido (O2–) (radical libre) se forma como producto final de la asimilación de la glucosa por la vía aerobia. Este es tóxico y es eliminado por la enzima superóxido dismutasa que lo transforma en oxígeno gaseoso y peróxido de hidrógeno.
El peróxido de hidrógeno también es tóxico para las bacterias y debe ser eliminado. La enzima catalasa desdobla el peróxido de hidrógeno en agua y oxígeno.
La catalasa puede actuar sobre otros sustratos diferentes al peróxido de hidrógeno, como alcoholes, aldehídos, ácidos, aminas aromáticas y fenoles. Sin embargo, el peróxido de hidrógeno puede ser utilizado también por la catalasa para oxidar otros compuestos tóxicos como el alcohol metílico y etílico.
Así mismo, la catalasa está presente en las células fagocíticas, protegiéndola de la acción tóxica del peróxido de hidrógeno.
Materiales
Peróxido de hidrógeno al 3% (10 volúmenes).
Lámina portaobjeto
Asa plástica desechable o palillo de madera.
Procedimiento
Tomar suficiente cantidad de la colonia a estudiar sin tocar el agar de donde proviene. La colonia debe ser fresca, es decir, de un cultivo de 18 a 24 horas.
Colocar la colonia sobre el portaobjeto seco y sobre ella agregar una gota de peróxido de hidrógeno al 3% (también se puede usar H2O2 al 30%). Observar inmediatamente si se desprenden burbujas o no.
Interpretación
Reacción positiva: desprendimiento de gas, que se evidencia con la formación de burbujas (burbujeo fuerte).
Reacción negativa: no hay formación de burbujas.
Colocar 1 ml de H2O2 al 3% sobre un cultivo puro en placas o en cuñas que no contenga sangre (preferiblemente agar nutritivo). Observar si existe o no formación de burbujas de forma inmediata. También se puede usar H2O2 al 30%.
Se interpreta igual que el método de porta objeto.
Llenar un tubo capilar de 67 mm a una altura de 20 mm con peróxido de hidrógeno al 3% por capilaridad.
Tocar la colonia aislada que se desea estudiar con el capilar lleno de H2O2 al 3%. Observar si el capilar se llena de burbujas en 10 segundos aproximadamente. Este método permite semi-cuantificar la reacción en cruces:
Sin cruces no hay burbujas (reacción negativa).
+ ———-Escasas burbujas (reacción débil o retardada).
++ ——–Abundante burbujas (reacción moderada).
+++ ——Las burbujas alcanzan el extremo contrario (reacción enérgica).
En un portaobjeto limpio y seco colocar una colonia aislada, luego colocar una gota de H2O2 al 0,5% y cubrir con un cubreobjetos. Observar si hay o no formación de burbujas aprisionadas.
Interpretación: la presencia de burbujas indica una reacción positiva. Sin burbujas, se interpreta como una reacción negativa.
Esta técnica necesita realizarse controlando el pH y la temperatura. Se debe ejecutar bajo una campana de flujo laminar, ya que la manipulación de las distintas especies de Mycobacterium es peligrosa.
Peróxido de hidrógeno al 30% o 110 volúmenes (superoxal).
Buffer fosfato pH 7
Tween 80 al 10%
Cultivo de Mycobacterium en cuña de 3 a 4 semanas
Buffer fosfato pH 7
Pesar:
1,361 g de (KH2PO4) fosfato monopotásico anhidro.
1,420 g de (Na2HPO3) fosfato disódico anhidro.
Disolver ambas sales en un poco de agua destilada estéril y completar con agua hasta 1000 ml.
Tween 80 al 10%
Realizar una dilución 1:10 al Tween 80 que viene comercialmente concentrado, para ello proceder de la siguiente manera:
Tomar 1 ml de Tween 80 y colocarlo en un poquito de agua destilada, disolver y luego completar el volumen con agua hasta 10 ml.
Reactivo final
Mezclar una cantidad de buffer fosfato con una cantidad de Tween 80 al 10% (a partes iguales). Definir en el laboratorio cuanto se desea preparar.
Colocar 5 ml de buffer fosfato en un tubo de ensayo estéril con tapa de rosca (Baquelita).
Con un asa de inoculación, tomar suficiente colonia de un crecimiento de Mycobacterium sembrado en cuñas y disolver en el buffer fosfato.
Tapar el tubo sin apretar demasiado la rosca. Colocar en un baño de María a 68°C por 20 a 30 minutos. Sacar y dejar enfriar a 22-25°C
Medir 0,5 ml del reactivo final (mezcla) y adicionarlo al tubo con la solución fría. Observar la formación o no de burbujas.
Se interpreta igual que las técnicas anteriores.
Cuando se obtiene un crecimiento de colonias en medios enriquecidos se le debe realizar una tinción de Gram y una prueba de catalasa a las colonias obtenidas. Esto orientará al microbiólogo sobre los procedimientos a seguir para la identificación definitiva.
Para evaluar el buen funcionamiento del reactivo de peróxido de hidrógeno use cepas controles recién cultivadas, tales como Staphylococcus aureus como control positivo y cepas de Streptococcus sp como control negativo.
Otra alternativa que sirve como control positivo es colocar una gota de peróxido de hidrógeno sobre el agar sangre, los eritrocitos tienen catalasa, por tanto, habrá un burbujeo si el reactivo está en buenas condiciones.
Se puede usar un agar chocolate como control negativo, aquí los eritrocitos ya están lisados y la prueba da negativa.
-No usar cultivos viejos para la prueba, ya que esto puede originar falsos negativos.
-Evitar tomar colonias a partir de cultivos en agar sangre, si se hace tener cuidado de no tocar el agar; este procedimiento puede provocar falsos positivos, ya que los eritrocitos contienen catalasa.
-Si toma la colonia con asa de platino no invierta el orden del procedimiento porque esto puede generar falsos positivos. Esto se debe a que el platino es capaz de reaccionar con el peróxido de hidrógeno, originando un burbujeo.
-No utilice el reactivo de peróxido de hidrógeno si está muy viejo, ya que el reactivo es muy inestable y tiende a descomponerse con el tiempo.
-Conservar el reactivo de peróxido de hidrógeno protegido de la luz y en refrigeración para evitar que se dañe.
-Realizar un control de calidad al reactivo de peróxido de hidrógeno cada vez que se use.
-Tomar en cuenta que si se usa el H2O2 al 30% las reacciones son más fuertes que las que se realizan con H2O2 al 3%.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Mac Faddin J. (2003). Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3era ed. Editorial Panamericana. Buenos Aires. Argentina.
- Laboratorios BD. Reactivo de catalasa-Gotario. Disponible en: http://winklerltda.cl
- Laboratorios Vadequímica. Agua oxigenada. Equivalencia entre volúmenes y porcentaje. Disponible en: vadequimica.com
