Antraceno: estructura, propiedades, toxicidad y usos
El antraceno es un hidrocarburo aromático policíclico (PAH) que está formado por la fusión de tres anillos bencénicos. Es un compuesto incoloro, pero bajo la irradiación de luz ultravioleta adquiere un color azul fluorescente. El antraceno sublima fácilmente.
Es un sólido blanco (imagen inferior), pero también puede presentarse como cristales incoloros monoclínicos, de un olor aromático suave. El antraceno sólido es prácticamente insoluble en el agua y es parcialmente soluble en los solventes orgánicos, especialmente en el disulfuro de carbono, CS2.

Fue descubierto en 1832 por August Laurent y Jean Dumas, usando como materia prima el alquitrán. Este material se continúa usando en la producción de antraceno, ya que contiene un 1,5 % del compuesto aromático. Asimismo, puede sintetizarse a partir de la benzoquinona.
Se encuentra en el medio ambiente como producto de la combustión parcial de los hidrocarburos fósiles. Se le ha encontrado en el agua potable, en el aire atmosférico, en los escapes de los vehículos automotores y en el humo de los cigarrillos. Aparece en la lista de la EPA (Agencia de Protección Ambiental de los Estados Unidos) de contaminantes ambientales más importantes.
El antraceno se dimeriza por la acción de la luz ultravioleta. Además, se hidrogena a 9,10-dihidroantraceno por la acción del zinc, manteniendo la aromaticidad de los anillos bencénicos restantes. Se oxida a antraquinona por reacción con el peróxido de hidrógeno.
Por frotamiento puede emitir luz y electricidad, oscureciéndose por la exposición a la luz solar.
Se usa como intermediario en la producción de tintas y colorantes, como la alizarina. Se emplea en la protección de la madera. También se utiliza como agente insecticida, acaricida, herbicida y raticida.
Índice del artículo
- 1 Estructura del antraceno
- 2 Propiedades
- 2.1 Nombres químicos
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Descripción física
- 2.5 Color
- 2.6 Olor
- 2.7 Punto de ebullición
- 2.8 Punto de fusión
- 2.9 Punto de ignición
- 2.10 Solubilidad en agua
- 2.11 Solubilidad en etanol
- 2.12 Solubilidad en hexano
- 2.13 Solubilidad en benceno
- 2.14 Solubilidad en disulfuro de carbono
- 2.15 Densidad
- 2.16 Densidad del vapor
- 2.17 Presión del vapor
- 2.18 Estabilidad
- 2.19 Auto-ignición
- 2.20 Descomposición
- 2.21 Calor de combustión
- 2.22 Capacidad calórica
- 2.23 Longitud de onda de absorción máxima (luz visible y ultravioleta)
- 2.24 Viscosidad
- 3 Nomenclatura
- 4 Toxicidad
- 5 Usos
- 6 Referencias
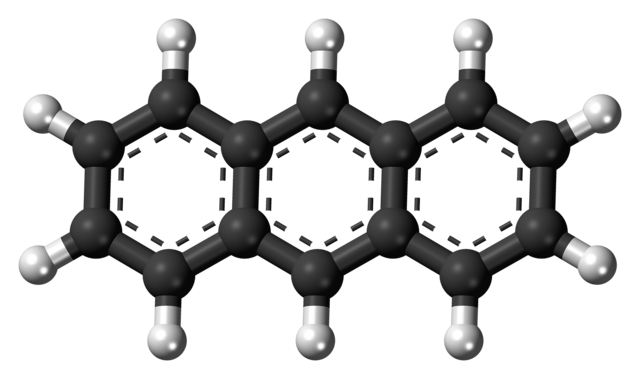
En la imagen superior se muestra la estructura del antraceno representada con un modelo de esferas y barras. Como puede verse, hay tres anillos aromáticos de seis carbonos; estos son anillos bencénicos. Las líneas punteadas indican la aromaticidad presente en la estructura.
Todos los carbonos tienen hibridación sp2, por lo que la molécula se encuentra en un mismo plano. Por lo tanto, el antraceno puede considerarse como una lámina pequeña y aromática.
Nótese además que los átomos de hidrógeno (las esferas blancas), a los laterales, prácticamente están descubiertos frente a una serie de reacciones químicas.
Las moléculas de antraceno interactúan mediante fuerzas de dispersión de London y apilamiento de sus anillos uno encima del otro. Por ejemplo, se puede ver que dos de estas “láminas” se juntan y al moverse los electrones de su nube π (los centros aromáticos de los anillos), logran mantenerse unidas.
Otra interacción posible es que los hidrógenos, con cierta carga parcial positiva, se sientan atraídos por los centros negativos y aromáticos de moléculas de antraceno vecinas. Y por lo tanto, estas atracciones ejercen un efecto direccional que orientan en el espacio las moléculas de antraceno.
Así, el antraceno se va ordenando de tal manera que adopta un patrón estructura a largo alcance; y por lo tanto, puede cristalizar en un sistema monoclínico.
Presumiblemente, estos cristales exhiben coloraciones amarillentas producto de su oxidación a antraquinona; el cual es un derivado del antraceno cuyo sólido es de color amarillo.
-Antraceno
-Paranaftaleno
-Antracina
-Aceite Verde
C14H10 o (C6H4CH)2.
178,234 g/mol.
Sólido blanco o amarillo pálido. Cristales monoclínicos producto de la recristalización en alcohol.
Cuando es puro el antraceno es incoloro. Con luz amarilla los cristales amarillos dan fluorescencia de un color azul. Puede también presentar ciertas tonalidades amarillentas.
Aromático suave.
341,3 ºC.
216 ºC.
250 ºF (121 ºC), copa cerrada.
Prácticamente insoluble en agua.
0.022 mg/L de agua a 0 ºC
0044 mg/L de agua a 25ºC.
0,76 g/kg a 16ºC
3,28 g/kg a 25 ºC. Nótese como es más soluble en etanol que en agua a la misma temperatura.
3,7 g/kg.
16,3 g/L. Su mayor solubilidad en benceno evidencia su alta afinidad por él, ya que ambas sustancias son aromáticas y cíclicas.
32,25 g/L.
1,24 g/cm3 a 68 ºF (1,25 g/cm3 a 23ºC).
6,15 (con relación al aire tomado como referencia igual a 1).
1 mmHg a 293 ºF (sublima). 6,56 x 10-6 mmHg a 25 ºC.
Es estable si se almacena en las condiciones recomendadas. Es triboluminiscente y triboeléctrico; esto significa que emite luz y electricidad cuando se le frota. El antraceno se oscurece cuando se expone a la luz solar.
1.004 ºF (540 ºC).
Se producen compuestos peligrosos por combustión (óxidos de carbono). Se descompone al calentarse bajo la influencia de oxidantes fuertes, produciendo un humo acre y tóxico.
40,110 kJ/kg.
210,5 J/mol·K.
λ máxima 345,6 nm y 363,2 nm.
-0,602 cPoise (240 ºC)
-0,498 cPoise (270 ºC)
-0,429 cPoise (300 ºC)
Como puede verse, disminuye su viscosidad a medida que aumenta la temperatura.
El antraceno es una molécula policíclica uniforme, y de acuerdo a la nomenclatura establecida para este tipo de sistema, su nombre real debería ser triceno. El prefijo tri se debe a que hay tres anillos bencénicos. Sin embargo, el nombre trivial antraceno se ha extendido y enraizado en la cultura popular y cientifícia.
La nomenclatura de los compuestos derivados de él suele ser un tanto compleja, y depende del carbono donde se da lugar la sustitución. La siguiente muestra la respectiva numeración de los carbonos para el antraceno:
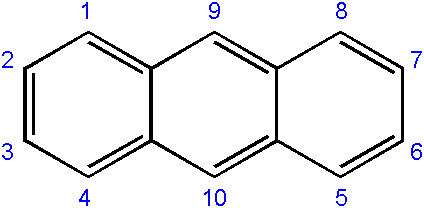
El orden de numeración se debe a la prioridad en reactividad o susceptibilidad de dichos carbonos.
Los carbonos de los extremos (1-4, y 8-5) son los más reactivos, mientras que los del medio (9-10), reaccionan mediante otras condiciones; por ejemplo, oxidativas, para formarse la antraquinona (9, 10-dioxoantraceno).
En contacto con la piel puede causar irritación, picazón y ardor, que se agravan con la luz solar. El antraceno es fotosensibilizante, lo que potencia el daño de piel producida por la radiación UV. Puede causar dermatitis aguda, telangiectasia y alergia.
En contacto con los ojos puede causar irritación y quemadura. Respirar antraceno puede irritar la nariz, la garganta y los pulmones, provocando tos y sibilancia.
La ingesta de antraceno se ha asociado en humanos con el dolor de cabeza, náuseas, pérdida de apetito, inflamación del tracto gastrointestinal, reacciones lentas y debilidad.
Ha habido sugerencias de una acción cancerígena del antraceno. Sin embargo, esta presunción no ha sido corroborada, inclusive algunos derivados del antraceno han sido utilizados en el tratamiento de ciertos tipos de cáncer.
-El antraceno es un semiconductor orgánico, usado como centellador en detectores de fotones de alta energía, electrones y partículas alfa.
-También se emplea para el recubrimiento de plásticos, como el poliviniltolueno. Esto con el fin de producir centelladores plásticos, con características semejantes al agua, para utilizarlo en la dosimetría de la radioterapia.
-El antraceno se emplea comúnmente como un trazador de radiación UV, aplicado en recubrimientos en tableros de circuitos impresos. Esto permite inspeccionar el revestimiento con luz ultravioleta.
Molécula bipedal
En el año 2005 los químicos de la Universidad de California, Riverside, sintetizaron la primera molécula bipedal: 9.10-ditioantratraceno. Esta se propulsa en línea recta cuando es calentada en una superficie plana de cobre, y puede moverse como si tuviera dos pies.
Los investigadores pensaban que la molécula era potencialmente utilizable en la computación molecular.
Piezocromaticidad
Algunos derivados de antraceno tienen propiedades piezocromáticas, es decir, tienen la capacidad de cambiar de color en función de la presión que se les aplica. Por lo tanto, pueden ser utilizados como detectores de presión.
También se utiliza el antraceno en la elaboración de las llamadas pantallas de humo.
Los hidrocarburos aromáticos policíclicos (PAH) son contaminantes ambientales, principalmente del agua, por lo que se hacen esfuerzos para reducir la presencia tóxica de estos compuestos.
El antraceno es un material (PAH) y se utiliza como modelo, para estudio de la aplicación del método de la pirolisis hídrica en la degradación de los compuestos PAH.
La pirolisis hídrica se usa en el tratamiento de aguas industriales. Su acción sobre el antraceno produjo la formación de los compuestos de oxidación: antrona, antroquinona y xantona, así como derivados del hidroantraceno.
Estos productos son menos estables que el antraceno y por lo tanto, son menos persistentes en el medio ambiente, pudiéndose ser más fácilmente eliminados que los compuestos PAH.
-El antraceno se oxida para originar la antroquinona, utilizada en la síntesis de tintes y colorantes
-El antraceno se utiliza en la protección de la madera. También se utiliza como insecticida, acaricida, herbicida y raticida.
-El antibiótico antraciclina ha sido empleado en la quimioterapia, ya que inhibe la síntesis del DNA y el RNA. La molécula de la antraciclina se intercala entre las bases DNA/RNA, inhibiendo la replicación de las células cancerosas de rápido crecimiento.
- Fernández Palacios S. y col. (2017). Piezochromic properties of pyridil divinyl anthracene derivatives: a joint Raman and DFT study. Universidad de Málaga.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2018). Anthracene. Recuperado de: en.wikipedia.org
- PubChem. (2019). Anthracene. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Somashekar M. N. and Chetana P. R. (2016). A Review on Anthracene and Its Derivatives: Applications. Research & Reviews: Journal of Chemistry.
