Teoría del Mar de Electrones: Fundamentos y Propiedades
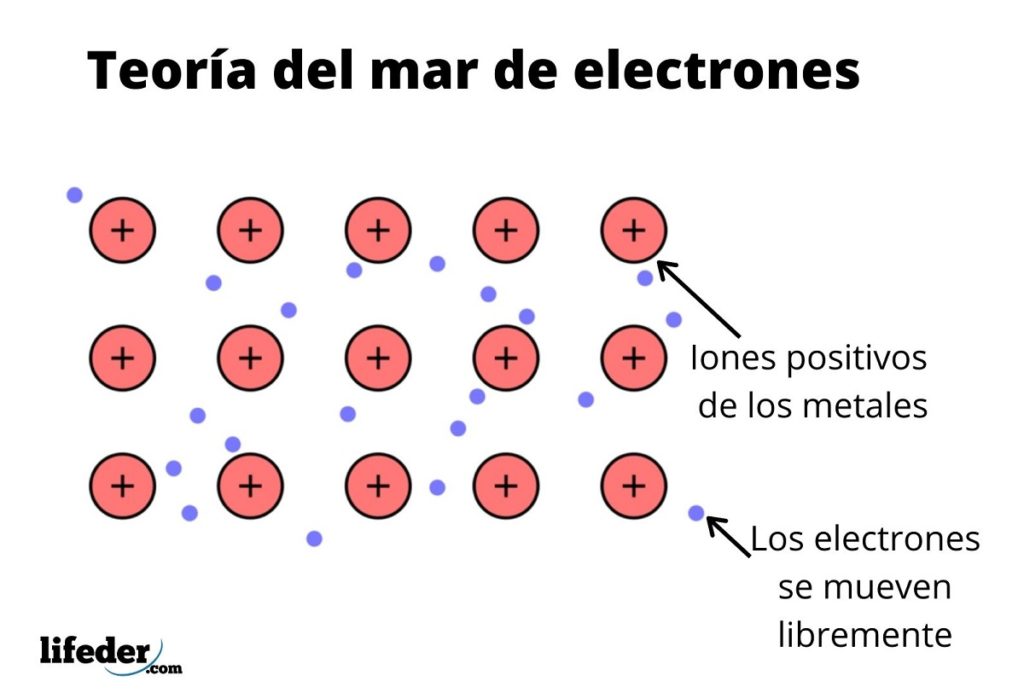
La teoría del mar de electrones es una hipótesis que explica un fenómeno químico excepcional que se da en los enlaces metálicos entre elementos con bajas electronegatividades. Se trata de la compartición de electrones entre distintos átomos unidos mediante enlaces metálicos.
La densidad electrónica entre estos enlaces es tal que los electrones están deslocalizados y forman un “mar” donde se mueven libremente. También puede expresarse mediante la mecánica cuántica: algunos electrones (suele haber de uno a siete por átomo) están dispuestos en orbitales con centros múltiples que se estiran por la superficie metálica.
Asimismo, los electrones conservan cierta localización en el metal, aunque la distribución de probabilidad de la nube electrónica posea una mayor densidad alrededor de algunos átomos específicos. Esto es debido a que al aplicarse una corriente determinada manifiestan su conductividad en una dirección específica.
Índice del artículo
- 1 Fundamentos de la teoría del mar de electrones
- 2 Propiedades
- 3 Inconvenientes de la teoría
- 4 Referencias
Los elementos metálicos poseen una gran tendencia a donar electrones de su último nivel energético (capa de valencia), debido a su energía de ionización tan baja con relación a los demás elementos.
Sabiendo esto, se podría considerar cada elemento metálico como un catión enlazado al electrón de su último nivel energético, que sería más propenso a donar.
Como en un metal se tiene un gran número de átomos que están enlazados entre sí, se puede suponer que dicho metal forma un grupo de cationes del metal que se encuentran sumidos en una especie de mar de electrones de valencia que poseen una gran deslocalización.
Considerando que las fuerzas de atracción electrostática que hay entre el catión (carga positiva) y el electrón (carga negativa) tienen a los átomos del metal enlazados fuertemente, se imagina a la deslocalización de los electrones de valencia comportándose como un adhesivo electrostático que conserva enlazados a los cationes del metal.
De esta manera, se puede inferir que mientras mayor sea el número de electrones presentes en la capa de valencia de un metal, esta especie de adhesivo electrostático tendrá una mayor fortaleza.
La teoría del mar de electrones ofrece una explicación simple a las características de las especies metálicas como resistencia, conductividad, ductilidad y maleabilidad, las cuales varían de un metal a otro.
Se ha descubierto que la resistencia conferida a los metales se debe a la gran deslocalización que presentan sus electrones, la cual genera una fuerza de cohesión muy alta entre los átomos que lo forman.
De este modo, se conoce la ductilidad como la capacidad de ciertos materiales de permitir la deformación de su estructura, sin ceder lo suficiente como para quebrarse, cuando son sometidos a determinadas fuerzas.
Tanto la ductilidad como la maleabilidad de un metal están determinadas por el hecho de que los electrones de valencia se deslocalizan en todas las direcciones en forma de capas, lo que hace que estas se desplacen unas encima de otras ante la acción de una fuerza externa, evitando el quiebre de la estructura del metal pero permitiendo su deformación.
Igualmente, la libertad de movimiento de los electrones deslocalizados permite que pueda haber un flujo de la corriente eléctrica, haciendo que los metales tengan muy buena conductividad de la electricidad.
Además, este fenómeno de movimiento libre de los electrones permite la transferencia de energía cinética entre las distintas regiones del metal, lo cual promueve la transmisión de calor y hace que los metales manifiesten una gran conductividad térmica.
Los cristales son sustancias sólidas que poseen propiedades físicas y químicas —como densidad, punto de fusión y dureza— que son establecidas por la clase de fuerzas que logran que las partículas que los conforman se mantengan unidas.
De cierto modo, se considera que los cristales de tipo metálico poseen las estructuras más sencillas, debido a que cada “punto” de la red del cristal ha sido ocupado por un átomo del propio metal.
En este mismo sentido, se ha determinado que generalmente la estructura de los cristales de metal es cúbica y se centra en las caras o en el cuerpo.
Sin embargo, estas especies también pueden tener forma hexagonal y poseer un empaquetamiento bastante compacto, lo cual les confiere esa enorme densidad que les es característica.
Debido a esta razón estructural, los enlaces que se forman en los cristales metálicos son distintos a los que se dan en las demás clases de cristales. En toda la estructura cristalina se encuentran deslocalizados los electrones que pueden formar enlaces, como se explicó anteriormente.

En los átomos metálicos existe una pequeña cantidad de electrones de valencia en proporción a sus niveles energéticos; es decir, hay una mayor cantidad de estados de energía disponibles que la cantidad de electrones enlazados.
Esto implica que, como hay una fuerte deslocalización electrónica y también bandas energéticas que se han llenado de manera parcial, los electrones pueden moverse a través de la estructura reticular cuando son sometidos a un campo eléctrico proveniente del exterior, además de formar el océano de electrones que admite la permeabilidad de la red.
Así que se interpreta la unión de los metales como un conglomerado de iones con carga positiva acoplados por un mar de electrones (de carga negativa).
Sin embargo, existen características que no se explican mediante este modelo, como la formación de determinadas aleaciones entre metales con composiciones específicas o la estabilidad de enlaces metálicos colectivos, entre otras.
Estos inconvenientes se explican mediante la mecánica cuántica, debido a que tanto esta teoría como muchas otras aproximaciones se han establecido con base en el modelo más simple de un solo electrón, mientras se intenta aplicar en estructuras mucho más complejas de átomos multielectrónicos.
- Wikipedia. (2018). Wikipedia. Recuperado de en.wikipedia.org
- Holman, J. S., y Stone, P. (2001). Chemistry. Recuperado de books.google.co.ve
- Parkin, G. (2010). Metal-Metal Bonding. Recuperado de books.google.co.ve
- Rohrer, G. S. (2001). Structure and Bonding in Crystalline Materials. Recuperado de books.google.co.ve
- Ibach, H., y Lüth, H. (2009). Solid-State Physics: An Introduction to Principles of Materials Science. Recuperado de books.google.co.ve
