Tinción de May Grünwald-Giemsa: fundamento, técnica y usos
La tinción de May Grünwald-Giemsa o Pappenheim es una técnica de coloración diferencial que mezcla los reactivos Giemsa y May Grünwald. Es utilizada para la diferenciación de células sanguíneas normales y anormales en frotis de sangre periférica y médula ósea, así como para la tinción de cortes histológicos y muestras citológicas.
Ambos reactivos —Giemsa y May Grünwald— se derivan de la tinción tipo Romanowsky, técnica que está basada en la combinación de colorantes ácidos y básicos.
Giemsa mejoró la técnica al estabilizar la mezcla de eosina, azul de metileno y sus derivados, con glicerol. En cambio, May Grünwald utiliza eosina y azul de metileno, usando como solvente el metanol. Esta combinación estratégica ha dado excelentes resultados.
Si bien en cuanto a la observación de morfología celular actúa de forma similar a las coloraciones de Giemsa y Wright, esta técnica mejora las anteriores afinando la coloración de los parásitos que causan el paludismo, el mal de Chagas, la leishmaniasis y la tricomoniasis.
Adicionalmente, ha mostrado ser una técnica muy útil para el estudio citológico del líquido espermático. Se ha destacado no solamente al mostrar las características morfológicas de los espermatozoides, sino que además permite diferenciar con gran eficacia los leucocitos, las células epiteliales y las células de la espermatogénesis.
Índice del artículo
- 1 Fundamento
- 2 Técnica
- 2.1 Materiales
- 2.2 Solución concentrada de colorante May Grünwald
- 2.3 Colorante de Giemsa concentrado
- 2.4 Preparación de la solución tampón a pH 7,2
- 2.5 Procedimiento de tinción de frotis sanguíneos o de médula ósea
- 2.6 Técnica para colorear extendidos de líquido espermático
- 2.7 Especificaciones importantes
- 3 Usos
- 4 Referencias
La técnica sigue el fundamento de las tinciones de Romanowsky, en las que los colorantes ácidos tienen afinidad selectiva por los componentes básicos celulares y los componentes ácidos atraen a los colorantes básicos.
Explicado de otra forma, tanto las estructuras celulares como los colorantes poseen cargas eléctricas positivas o negativas; las cargas iguales se repelen y las cargas diferentes se atraen.
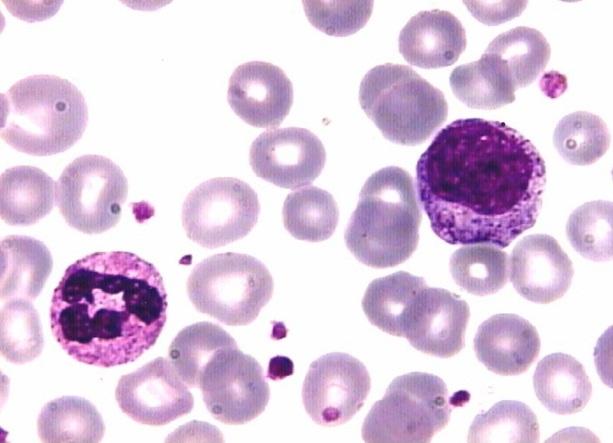
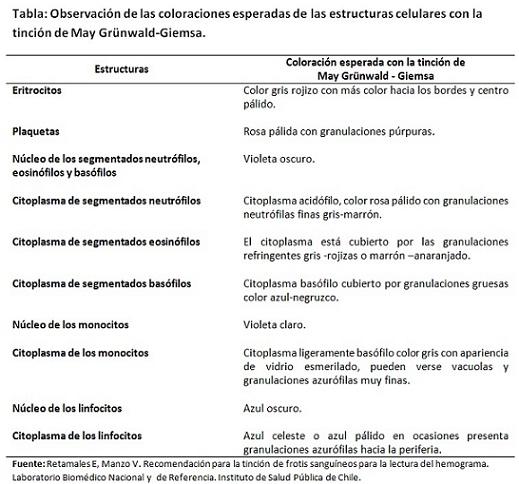
Por ejemplo, los colorantes básicos como el azul de metileno están cargados positivamente y son atraídos por las estructuras cargadas negativamente. Es por ello que este colorante tiñe los núcleos que son ricos en ADN y ARN que poseen grupos fosfatos cargados negativamente.
También se tiñen los gránulos de los segmentados basófilos y los citoplasmas de los glóbulos blancos mononucleares que contienen ARN.
Así mismo, el colorante ácido lleva carga negativa, por lo que se une a estructuras cargadas positivamente como los eritrocitos y los gránulos de los segmentados eosinófilos. En cuanto a los gránulos de los segmentados neutrófilos, estos fijan ambos colorantes.
En esta técnica coexiste una combinación de reacciones entre los colorantes ortocromáticos y los metacromáticos. Los ortocromáticos (la eosina y el azul de metileno) se fijan a la estructura celular a la que son afines y proporcionan un color estable que no varía.
En cambio, los metacromáticos (los derivados del azul de metileno azure A y azure B), varían su color original una vez unidos a la estructura específica, pudiendo incluso haber variedad de matices.
Finalmente, el paso que lleva la solución May Grünwald necesita la presencia de agua, pues sin este el colorante penetrará las estructuras pero no se fijará. Para que ello ocurra el colorante debe volverse polar o ionizarse, y así ser capaz de precipitar y fijarse a las estructuras afines.
– Láminas portaobjetos.
– Puentes de coloración.
– Solución de May-Grünwald.
– Tinción de Giemsa.
– Agua destilada.
Se deben pesar 0,25 gr de eosina-azul de metileno (colorante según May Grünwald) y disolver en 100 ml de metanol. Luego se mezcla la preparación durante 1 hora y se deja reposar por 24 horas. Finalizado el tiempo, se filtra.
Para aplicar la técnica debe diluirse el colorante May Grünwald de la siguiente manera: para 200 ml de colorante diluido se miden 30 ml de la solución concentrada, se agregan 20 ml de solución tampón y 150 ml de agua destilada ajustada a pH7.2-7.3. Posteriormente se mezcla y se filtra.
Se deben pesar 0,5 gr de azur-eosina-azul de metileno (colorante según Giemsa), disolver en 50 ml de metanol y colocar a la mezcla 50 ml de glicerina.
Para ejecutar la técnica se diluye 1:10 con solución tampón y se deja reposar por 10 minutos. Se puede filtrar si es necesario.
Deben pesarse:
– 40 mg de potasio di-hidrógeno fosfato (KH2PO4).
– 151 mg de di-sodio hidrógeno fosfato 12-hidrato (Na2HPO4).
Se disuelven ambos compuestos en 100 ml de agua.
Existen dos modalidades: una clásica y una rápida.
Modalidad clásica
- Cubrir los frotis durante 2 o 3 minutos con la solución de May-Grünwald diluida.
- Lavar con agua destilada tamponada para eliminar la solución anterior.
- Cubrir con la misma solución de lavado tamponada y dejar por 1 minuto. La idea es que el colorante anterior se fije a las estructuras y que, al mismo tiempo, se hidraten las células.
- Agregar 12 gotas de tintura de Giemsa diluida sobre el agua tamponada y soplar para mezclar y homogeneizar. Dejar reposar durante 15 o 20 minutos.
- Lavar los frotis con agua destilada tamponada y colocarlo a secar al aire.
- Enfocar y observar en un microscopio óptico las células sanguíneas teñidas utilizando el objetivo de 40X. Si es necesario, puede usarse el de 100X.
Modalidad rápida
- Cubrir el frotis con el colorante May Grünwald diluido durante 1 minuto.
- Lavar con agua destilada tamponada.
- Cubrir con agua tamponada y dejar reposar por 1 minuto.
- Colocar el colorante Giemsa diluido y dejar por 5 minutos.
- Lavar con agua destilada tamponada y dejar secar al aire.
Las técnicas aquí descritas son una guía orientadora, pero se debe tener en cuenta que los procedimientos y los tiempos de coloración varían de acuerdo con la casa comercial que expende los reactivos. Se aconseja seguir los pasos estrictamente señalados por cada casa comercial.
1- Cubrir el extendido con una capa fina de la solución May Grünwald por 4 minutos.
2- Retirar el colorante y lavar con agua destilada.
3- Colocar una capa de Giemsa diluido (1:10) en agua destilada durante 15 minutos.
4- Retirar el colorante y lavar con agua destilada.
5- Dejar secar y observar en el microscopio.
La técnica precisa que los reactivos y las soluciones de lavado presenten un pH ajustado a 7.2 -7.3, para que las afinidades de los colorantes por las estructuras celulares no se distorsionen y no varíe el color final esperado.
Esta técnica es utilizada por los laboratorios clínicos para teñir frotis de sangre periférica y médula ósea, cortes de tejidos y citologías.
En el ámbito hematológico, esta técnica es de vital importancia en el estudio de anormalidades de las células en cuanto a forma, tamaño y número. Es una herramienta muy valiosa para el diagnóstico de ciertas enfermedades, como leucemias y anemias.
Además, presenta una destacada utilidad cuando se buscan parásitos en los ámbitos hematológico (Plasmodium sp y Tripanosoma cruzi) o histológico (Leishmanias sp).
En cuanto a citología vaginal, esta técnica es especialmente ventajosa para la observación de Trichomonas vaginalis. Este es un hallazgo importante, ya que su presencia simula cuadros de carcinoma in situ que luego desaparecen cuando se elimina el parásito.
Ha sido una herramienta ideal para el estudio de muestras espermáticas, dado que brinda información valiosa sobre la calidad de los espermatozoides.
Los datos que ofrece tienen que ver principalmente con número y morfología, así como con las células concomitantes que puedan estar presentes y que son de vital importancia, como las células germinales, los leucocitos y las células epiteliales.
Con este análisis es posible describir anormalidades observadas en los espermatozoides en la cabeza, el cuello, la pieza media y la pieza principal.
Además, también pueden ayuda a evidenciar casos de hemospermia (presencia de hematíes en el semen) y leucospermia o piospermia (aumento del número de leucocitos en el semen).
- Costamagna S, Prado M. Validación del examen en fresco, coloraciones de May Grünwald-Giemsa y Gram y medios de cultivo para el diagnostico de Trichomonas vaginalis. Parasitol. 2001; 25 (1-2): 60-64. Disponible en: scielo.
- Laboratorio Merck KGaA. May Grünwald eosina azul de metileno para microscopía.
- “Tinción de May-Grünwald-Giemsa.” Wikipedia, La enciclopedia libre. 15 nov 2018, 14:37 UTC. 8 ene 2019, 04:29: es.wikipedia.org
- Laboratorio Glass Chemicals Panreac. Reactivos para técnicas histológicas, hematología y microbiología. Disponible en: glasschemicals.com
- Retamales E, Manzo V. Recomendación para la tinción de frotis sanguíneos para la lectura del hemograma. Laboratorio Biomédico Nacional y de Referencia. Instituto de Salud Pública de Chile.
- Sarabia L. Espermiograma según los criterios de la OMS. Programa de Anatomía y Biología del desarrollo. Facultad de Medicina. Universidad de Chile. Disponible en: pp.centramerica.com
