Lipasa pancreática: estructura, funciones, valores normales
Las lipasas pancreáticas (triacilglicerol acil-hidrolasas) son enzimas secretadas por el páncreas hacia el intestino delgado y que son las encargadas de la digestión de los triglicéridos consumidos en la dieta, produciendo ácidos grasos libres y glicerol.
En otras palabras, son enzimas que digieren grasas, especialmente las grasas neutras, que son las más abundantes en los alimentos (triglicéridos). Estas grasas consisten en un núcleo de glicerol al cual están esterificadas tres moléculas de ácidos grasos.
En las secreciones pancreáticas también están contenidas otras enzimas que degradan grasas y que se conocen como las fosfolipasas A y B, capaces de degradar el ácido graso de la lecitina y de la isolecitina, respectivamente.
El páncreas es un órgano con función dual; por un lado, secreta hormonas que tienen que ver con el metabolismo de los carbohidratos (insulina y glucagón) y, por otro, secreta enzimas para la función digestiva como las lipasas (que digieren grasas), las proteasas (que digieren proteínas) y las amilasas (que digieren carbohidratos).
A diferencia de las proteasas, las lipasas pancreáticas son secretadas al intestino delgado como proteínas activas y su actividad puede incrementarse en presencia de los ácidos biliares y otros compuestos.
El jugo pancreático no solo está compuesto por enzimas, sino que también contiene líquido y otros componentes químicos, como el bicarbonato por ejemplo, todos sintetizados por células distintas del páncreas y bajo estrictos mecanismos de regulación.
Algunas enfermedades pancreáticas se caracterizan por un déficit enzimático con secreción de líquido normal o viceversa, es decir, un déficit de secreción de líquido y secreción enzimática normal.
Índice del artículo
En los seres humanos, la lipasa pancreática es una enzima compuesta por una sola cadena polipeptídica, con un peso molecular cercano a los 50 kDa, similar a la enzima de los bovinos, ovinos y porcinos.
Es una glicoproteína que posee en su porción glucídica residuos de manosa, fucosa, galactosa, glucosa y N-acetil glucosamina. En los humanos se ha propuesto que existen dos isoenzimas de la lipasa pancreática con puntos isoeléctricos de 5.80 y 5.85, respectivamente.
De acuerdo con algunos estudios, esta enzima es codificada por un gen que posee alrededor de 1.395 nucleótidos, cuyo producto traduccional corresponde a una molécula de unos 465 aminoácidos.
El extremo N-terminal de la proteína completamente procesada y madura está precedido por una secuencia o péptido señal de 16 aminoácidos hidrofóbicos, que cumplen un importante papel en la traslocación de esta enzima tras su síntesis.
La enzima de los humanos posee un sitio activo ubicado en el extremo C-terminal, donde existe una triada de aminoácidos: Asp-His-Ser, de los cuales la serina parece ser el más importante catalíticamente hablando.
Esta enzima es secretada en su forma activa, pero su actividad aumenta en presencia de aminoácidos, iones de calcio y sales biliares. Las sales biliares, específicamente, se encargan de reducir el pH del lumen intestinal de 8.1 a 6, que es el pH óptimo para la enzima.
Algunos autores señalan que, si la concentración de sales biliares aumenta demasiado, la lipasa pancreática es inhibida, pero dicha inhibición es contrarrestada o revertida por otra enzima, la colipasa, que funciona como un cofactor de la lipasa pancreática y que es codificada por genes diferentes a la primera.
Sin embargo, algunos autores afirman que la lipasa pancreática, así como las fosfolipasas, son, en realidad, sintetizadas y secretadas como “zimógenos” inactivos, que requieren para su activación una digestión proteolítica llevada a cabo por la enzima tripsina, también contenida en los jugos pancreáticos.
También se ha demostrado que la presencia excesiva de sales de metales pesados como el cobre, el hierro y el cobalto es inhibitoria para la lipasa pancreática. Lo mismo que la presencia de halógenos, de yodo, de flúor y de bromo.
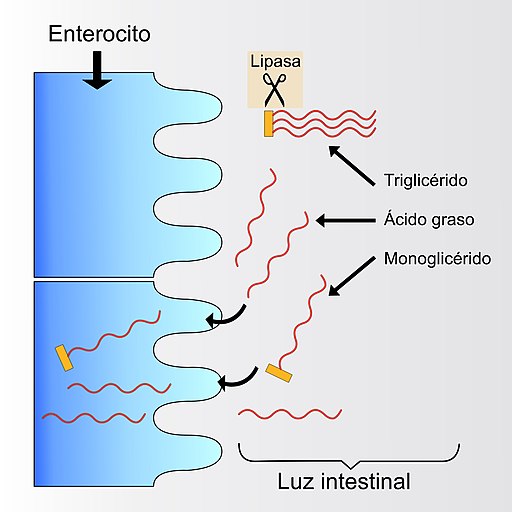
La función principal de la enzima lipasa pancreática es la de promover la digestión intestinal de los triglicéridos ingeridos con la dieta, función que consigue al hidrolizar estos compuestos y liberar una mezcla de diglicéridos, monoglicéridos, ácidos grasos libres y moléculas de glicerol.
Por lo general, la lipasa pancreática hidroliza los enlaces en las posiciones 1 y 3 de los triglicéridos que ataca; también cataliza la digestión de algunos ésteres sintéticos y, en ambos casos, solo puede hacerlo en la interfase entre el agua y las grasas, por lo que mientras más “fina” es la emulsión, existe una mayor actividad lipasa.
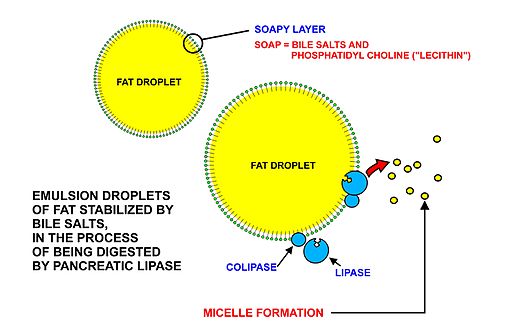
El primer paso para la digestión de las grasas en el intestino delgado es su “emulsificación” en el líquido intestinal, debido a la presencia de las sales biliares procedentes del hígado y a los movimientos peristálticos intestinales.
Es importante señalar que, en el proceso de la digestión de las grasas, los ácidos grasos libres de cadena corta (entre 2 y 10 átomos de carbono) y las moléculas de glicerol son rápidamente absorbidas a través de la mucosa intestinal.
Los triglicéridos, usualmente caracterizados por la presencia de ácidos grasos de cadena larga (de más de 12 átomos de carbono) son digeridos por las lipasas pancreáticas una vez estos se han “acomodado” en unas estructuras conocidas como micelas, producto de la emulsificación.
El páncreas, como todo órgano del cuerpo, puede estar sujeto a distintas enfermedades de origen infeccioso, inflamatorio, tumoral, tóxico o traumático, que pueden tener serias implicaciones para el funcionamiento sistémico.
Las enzimas amilasa y lipasa pancreática son, a menudo, empleadas como indicadores séricos de algunas patologías relacionadas con el sistema digestivo y sus glándulas accesorias.
Se ha comprobado que usualmente niveles altos de lipasas en el suero pueden deberse a una pancreatitis, y lo mismo se ha propuesto respecto a otra enzima producida por el páncreas, la amilasa.
Los valores normales de la lipasa pancreática en el ser humano están entre 0 y 160 U/L en el plasma, mientras que una cifra mayor a las 200 U/L es un valor en el cual se sospecha la presencia de pancreatitis u otra afección pancreática.
El nivel de lipasa pancreática no solo puede aumentar en el suero debido a la inflamación del páncreas (pancreatitis) crónica o aguda, sino que también puede ser un indicio de cáncer pancreático, de gastroenteritis severa, de úlceras duodenales, de infecciones con el VIH, etc.
También puede darse en las personas que poseen deficiencia familiar de la lipoproteína lipasa.
- Best, C. H., & Taylor, N. B. (1961). The physiological basis of medical practice (Vol. 541). Baltimore: Williams & Wilkins.
- De Caro, A., Figarella, C., Amic, J., Michel, R., & Guy, O. (1977). Human pancreatic lipase: a glycoprotein. Biochimica et Biophysica Acta (BBA)-Protein Structure, 490(2), 411-419.
- Frank, B., & Gottlieb, K. (1999). Amylase normal, lipase elevated: is it pancreatitis? The American journal of gastroenterology, 94(2), 463.
- Hall, J. E. (2015). Guyton and Hall textbook of medical physiology e-Book. Elsevier Health Sciences.
- Marcin, J. (2017). Healthline. Retrieved December 26, 2019, from www.healthline.com/health/amylase-and-lipase-tests
- Ruch, T. C., Patton, H. D., & Howell, W. H. (1973). Physiology and biophysics. Saunders.
- Winkler, F. K., d’Arcy, A., & Hunziker, W. (1990). Structure of human pancreatic lipase. Nature, 343(6260), 771.
