Óxido de plata (Ag2O): estructura, propiedades y usos
El óxido de plata es un compuesto inorgánico cuya fórmula química es Ag2O. La fuerza que une sus átomos es de naturaleza enteramente iónica; por lo tanto, consta de un sólido iónico donde existe una proporción de dos cationes Ag+ interaccionando electrostáticamente con un anión O2-.
El anión óxido, O2-, resulta de la interacción de los átomos de plata de la superficie con el oxígeno del ambiente; de manera muy similar a como lo hace el hierro y muchos otros metales. Una pieza o alhaja de plata en lugar de enrojecerse y desmenuzarse en herrumbres, se va tornando de color negro, característico del óxido de plata.

Por ejemplo, en la imagen superior puede apreciarse una copa de plata oxidada. Nótese su superficie ennegrecida, aunque conserva todavía algo de lustre ornamental; razón por la cual incluso los objetos de plata oxidada pueden considerarse lo suficiente atractivos para usos decorativos.
Las propiedades del óxido de plata son tal que no carcomen, a primera vista, la superficie metálica original. Se forma a temperatura ambiente por simple contacto con el oxígeno del aire; y aún más interesante, puede descomponerse a elevadas temperaturas (por encima de 200°C).
Esto significa que si se agarrara la copa de la imagen, y se le aplicara el calor de una llama intensa, recobraría sus brillos plateados. Por lo tanto, su formación es un proceso termodinámicamente reversible.
El óxido de plata tiene además otras propiedades y, más allá de su simple fórmula Ag2O, abarca organizaciones estructurales complejos y una rica variedad de sólidos. Sin embargo, el Ag2O es quizás, junto al Ag2O3, el más representativo de los óxidos de la plata.
Índice del artículo
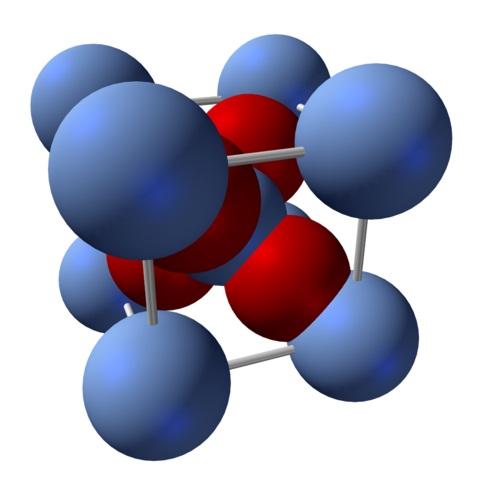
¿Cómo es su estructura? Como se mencionó al principio: es un sólido iónico. Por esta razón no puede haber enlaces covalentes Ag-O ni Ag=O en su estructura; ya que, de haberlos, las propiedades de este óxido cambiarían drásticamente. Se trata entonces de iones Ag+ y O2- en una proporción 2:1 y experimentando una atracción electrostática.
La estructura del óxido de plata viene determinada en consecuencia por el modo en que las fuerzas iónicas disponen en el espacio los iones Ag+ y O2-.
En la imagen superior, por ejemplo, se tiene una celda unitaria para un sistema cristalino cúbico: los cationes Ag+ son las esferas azul plateadas, y los O2- las esferas rojizas.
Si se cuentan el número de esferas, se hallará que hay, a simple vista, nueve de colores azules plateados y cuatro rojas. No obstante, solo se toma en consideración los fragmentos de las esferas contenidos dentro del cubo; de contar estos, siendo fracciones de las esferas totales, debe cumplirse la proporción 2:1 para el Ag2O.
Repitiendo la unidad estructural del tetraedro AgO4 rodeado de otros cuatro Ag+, se construye todo el sólido de color negro (obviando los huecos o irregularidades que pueden tener estos arreglos cristalinos).
Centrándose ahora no en el tetraedro AgO4 sino en la línea AgOAg (observar los vértices del cubo superior), se tendrá que el sólido de óxido de plata consta, desde otra perspectiva, de múltiples capas de iones dispuestos linealmente (aunque inclinados). Todo esto como resultado de la geometría “molecular” alrededor del Ag+.
Lo anterior ha sido corroborado por varios estudios de su estructura iónica.
La plata trabaja predominantemente con valencia +1, ya que al perder un electrón su configuración electrónica resultante es [Kr]4d10, la cual es muy estable. Otras valencias, como Ag2+ y Ag3+ son menos estables ya que pierden electrones de orbitales d casi llenos por completo.
El ion Ag3+, no obstante, es relativamente menos inestable comparado a Ag2+. De hecho, puede coexistir en compañía del Ag+ enriqueciendo químicamente la estructura.
Su configuración electrónica es [Kr]4d8, con electrones desapareados de tal forma que le otorga cierta estabilidad.
A diferencia de las geometrías lineales entorno a los iones Ag+, se ha encontrado que la de los iones Ag3+ es plano cuadrado. Por lo tanto, un óxido de plata con iones Ag3+ consistiría de capas compuestas por cuadrados de AgO4 (no tetraedros) unidos electrostáticamente por líneas AgOAg; tal es el caso del Ag4O4 o Ag2O∙Ag2O3 con estructura monoclínica.

Si se raspara la superficie de la copa de plata de la imagen principal, se obtendría un sólido, que no solo es de color negro, sino que además tiene tonalidades marrones o de color café (imagen superior). Algunas de sus propiedades físicas y químicas reportadas por los momentos son las siguientes:
231,735 g/mol
Sólido negro marrón en forma de polvo (nótese que a pesar de ser un sólido iónico, carece de apariencia cristalina). Es inodoro y mezclado con agua le confiere un sabor metálico
7,14 g/mL.
277-300°C. Ciertamente, se funde en plata sólida; es decir, se descompone probablemente antes de formar el óxido líquido.
1,52∙10-8 en agua a 20°C. Es por tanto un compuesto apenas soluble en agua.
Si se observa detenidamente la imagen de su estructura se encontrará que las esferas de Ag2+ y O2- no discrepan casi en tamaño. Esto trae como consecuencia que solo moléculas pequeñas puedan traspasar el interior de red cristalina, haciéndolo insoluble en casi todos los solventes; a excepción de aquellos donde reacciona, como las bases y los ácidos.
Aunque se ha dicho en reiteradas oportunidades que el óxido de plata es un compuesto iónico, ciertas propiedades, como su bajo punto de fusión, contradicen esta afirmación.
Ciertamente, la consideración del carácter covalente no desmorona lo explicado para su estructura, pues bastaría con adicionar en la estructura del Ag2O un modelo de esferas y barras para indicar los enlaces covalentes.
Asimismo, los tetraedros y planos cuadrados AgO4, así como las líneas AgOAg, estarían unidos por enlaces covalentes (o iónico covalentes).
Con esto en mente, el Ag2O sería en realidad un polímero. No obstante, se recomienda considerarlo como un sólido iónico con carácter covalente (cuya naturaleza del enlace sigue siendo un desafío hoy en día).
Al principio se hizo mención de que su formación es termodinámicamente reversible, por lo que absorbe calor para regresar a su estado metálico. Todo esto puede expresarse mediante dos ecuaciones químicas para tales reacciones:
4Ag(s) + O2(g) => 2Ag2O(s) + Q
2Ag2O(s) + Q => 4Ag(s) + O2(g)
Donde Q representa al calor en la ecuación. Esto explica por qué el fuego quemando la superficie de la copa de plata oxidada le regresa su brillo plateado.
Por lo tanto, es difícil suponer que haya Ag2O(l) ya que se descompondría al instante por el calor; a menos, que se eleve demasiado la presión para obtener dicho líquido negro marrón.
Cuando se introdujo la posibilidad de iones Ag2+ y Ag3+ además del común y predominante Ag+, el término ‘óxido de plata’ comienza a parecer insuficiente para referirse al Ag2O.
Esto se debe a que el ion Ag+ es más abundante que los otros, por lo que se toma el Ag2O como único óxido; lo cual no es correcto del todo.
Si se considera el Ag2+ como prácticamente inexistente dado su inestabilidad, se tendrá entonces solamente los iones con valencias +1 y +3; es decir, Ag(I) y Ag(III).
Al ser el Ag(I) el de menor valencia, se le nombra adicionando el sufijo –oso a su nombre argentum. Así, el Ag2O es: óxido argentoso o, de acuerdo a la nomenclatura sistemática, monóxido de diplata.
Si se ignora completamente al Ag(III), entonces su nomenclatura tradicional debe ser: óxido argéntico en lugar de óxido argentoso.
Por otro lado, el Ag(III) al ser la mayor valencia se le adiciona el sufijo –ico a su nombre. Así, el Ag2O3 es: óxido argéntico (2 iones Ag3+ con tres O2-). Asimismo, su nombre de acuerdo a la nomenclatura sistemática sería: trióxido de diplata.
Si se observa la estructura del Ag2O3, se puede presumir que es producto de una oxidación por ozono, O3, en lugar de oxígeno. Por lo tanto, su carácter covalente debe ser mayor al tratarse de compuesto covalente con enlaces Ag-O-O-O-Ag o Ag-O3-Ag.
El AgO, escrito también como Ag4O4 o Ag2O∙Ag2O3, es un óxido de plata (I, III), ya que posee ambas valencias +1 y +3. Su nombre de acuerdo a la nomenclatura sistemática sería: tetraóxido de tetraplata.
Esta nomenclatura es de gran ayuda cuando se trata de otros óxidos de plata estequiométricamente más complejos. Por ejemplo, supóngase los dos sólidos 2Ag2O∙Ag2O3 y Ag2O∙3Ag2O3.
Escribiendo el primero de manera más apropiada sería: Ag6O5 (contando y sumando los átomos de Ag y O). Su nombre sería entonces pentóxido de hexaplata. Nótese que este óxido tiene una composición de plata menos rica que el Ag2O (6:5 2:1).
Mientras que escribiendo de otra manera el segundo sólido, sería: Ag8O10. Su nombre sería decaóxido de octaplata (con una proporción 8:10 o 4:5). Este hipotética óxido de plata estaría “muy oxidado”.
Los estudios en busca de nuevos y sofisticados usos para el óxido de plata se siguen realizando actualmente. Algunos de sus usos se listan a continuación:
-Se disuelve en amoníaco, nitrato de amonio y agua para formar el reactivo de Tollens. Este reactivo es una herramienta útil en los análisis cualitativos dentro de los laboratorios de química orgánica. Permite determinar la presencia de aldehídos en una muestra, siendo como respuesta positiva la formación de un “espejo de plata” en el tubo de ensayo.
-Junto con el zinc metálico conforma las baterías primarias de zinc-óxido de plata. Este es quizás uno de sus usos más comunes y hogareños.
-Sirve como purificador de gases, absorbiendo por ejemplo CO2. Al calentársele, libera los gases atrapados y puede reutilizarse varias veces.
-Debido a las propiedades antimicrobianas de la plata, su óxido tiene utilidad en estudios de bioanálisis y purificación de los suelos.
-Es un agente oxidante suave capaz de oxidar los aldehídos a ácidos carboxílicos. Asimismo, se utiliza en la reacción de Hofmann (de aminas terciarias) y participa en otras reacciones orgánicas, ya sea como reactivo o catalizador.
- Bergstresser M. (2018). Silver Oxide: Formula, Decomposition & Formation. Study. Recuperado de: study.com
- Authors and editors of the volumes III/17E-17F-41C. (s.f.). Silver oxides (Ag(x)O(y)) crystal structure, lattice parameters. (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). The Potential Impact of Biofield Energy Treatment on the Physical and Thermal Properties of Silver Oxide Powder. International Journal of Biomedical Science and Engineering. Vol. 3, No. 5, pp. 62-68. doi: 10.11648/j.ijbse.20150305.11
- Sullivan R. (2012). Decomposition of silver oxide. University of Oregon. Recuperado de: chemdemos.uoregon.edu
- Flint, Deyanda. (24 de abril de 2014). Uses of Silver Oxide Batteries. Sciencing. Recuperado de: sciencing.com
- Salman Montasir E. (2016). Study of Some optical properties of silver oxide ( Ag2o ) using UVVisible spectrophotometer. [PDF]. Recuperado de: iosrjournals.org
- Bard Allen J. (1985). Standard Potentials in Aqueous Solution. Marcel Dekker. Recuperado de: books.google.co.ve
