Reactivo de Grignard: preparación, aplicaciones, ejemplos
El reactivo de Grignard es una familia de compuestos organometálicos que tiene como fórmula general RMgX, donde R representa un radical hidrocarbonado: un grupo alquilo, arilo, vinilo, etc. Mientras, X representa un halógeno: yodo, bromo o cloro. El flúor no se usa en el reactivo de Grignard.
El reactivo debe su nombre a su creador, el químico francés Victor Grignard en el año 1900, haciéndose merecedor al premio Nobel en 1912 por su trabajo. Se prepara mediante la reacción de un organohalógeno con magnesio, preferiblemente en una atmósfera de nitrógeno.
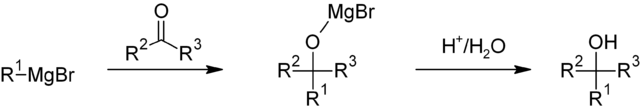
En dicha reacción se suele usar como solvente el éter dietílico o el tetrahidrofurano (THF). Mientras, el agua debe evitarse, ya que reacciona fuertemente con el reactivo de Grignard. Este reactivo es una base fuerte y un nucleófilo, es decir, al reaccionar cede un par de electrones.
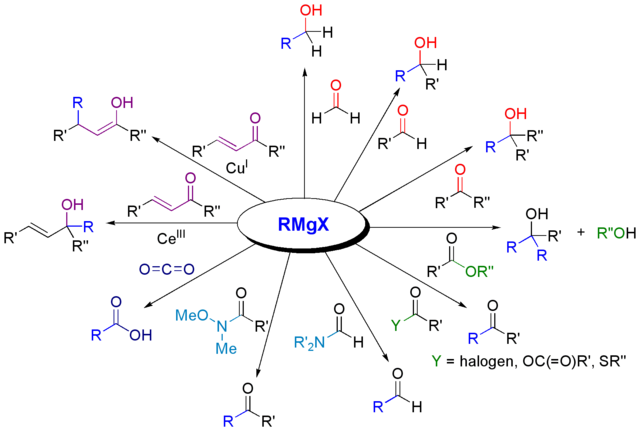
El reactivo de Grignard reacciona con casi todos los compuestos orgánicos, a excepción de los hidrocarburos, los éteres y las aminas terciarias. Las reacciones de Grignard tienen como objetivo la síntesis de nuevos compuestos mediante la creación de nuevos enlaces carbono-carbono.
También reaccionan con los compuestos halogenados de ciertos metales para formar sus derivados alquilos.
Índice del artículo
- 1 Preparación del reactivo de Grignard
- 2 Aplicaciones
- 2.1 Reacción del reactivo de Grignard con el formaldehido
- 2.2 Reacción del reactivo de Grignard con un aldehido
- 2.3 Reacción del reactivo de Grignard con una cetona
- 2.4 Reacción del reactivo de Grignard con un éster
- 2.5 Reacción del reactivo de Grignard con un epóxido
- 2.6 Reacción del reactivo de Grignard con el dióxido de carbono
- 3 Ejemplos
- 4 Referencias
Los reactivos de Grignard se preparan agregando a los organohalógenos (RX), pequeños trozos de magnesio. El magnesio debe ser previamente activado, ya que se suele presentar en forma de cintas recubiertas con óxido de magnesio, el cual lo incapacita para usarse en la reacción de Grignard.
La preparación se realiza en un matraz que contiene éter dietílico o tetrahidrofurano como solvente, con el organohalógeno (RX) y el magnesio. El matraz está dotado de un condensador de reflujo, con el fin de reducir la pérdida del solvente por evaporación.
Los componentes de la mezcla se calientan en un baño de agua por 20 o 30 minutos, ocurriendo la reacción siguiente:
RX + Mg → RMgX
Los solventes usados deben ser apróticos, es decir, sin hidrógenos ácidos. El agua y los alcoholes deben evitarse, ya que protonan el reactivo de Grignard, provocando su destrucción:
RMgX + H2O → RH + Mg(OH)X
Esto ocurre porque el carbono del reactivo de Grignard es muy nucleófilo, lo que lleva a la formación de un hidrocarburo. También se recomienda que la reacción se realice en una atmósfera de nitrógeno, para evitar la acción del oxígeno.
El reactivo de Grignard es sensible a la humedad y al oxígeno, por lo que se realizan pruebas de su buen estado, usándose indicadores de ello, tales como el mentol, la fenantrolina o la 2,2’-biperidina.
La principal aplicación sintética del reactivo de Grignard es su reacción con compuestos que tienen grupos carbonilos para la producción de alcoholes. La formación de enlaces carbono-carbono es rápida y exotérmica cuando el reactivo de Grignard reacciona con un aldehído o una cetona.
El formaldehido reacciona con el reactivo de Grignard para originar un alcohol primario. Esta reacción ocurre en dos etapas.
En la primera etapa el formaldehido reacciona con el reactivo de Grignard en presencia del solvente éter dietílico, formándose un complejo del formaldehido y el reactivo de Grignard.
En una segunda etapa se produce la hidrólisis del complejo anterior por la acción del ácido sulfúrico diluido (H3O+), produciéndose un alcohol primario que presenta un carbono adicional al número de carbonos presentados por el reactivo de Grignard.
Para simplificar la representación del proceso global, las dos etapas se sintetizan en una para hacer aparecer como si el proceso de formación del alcohol primario ocurriese en una sola etapa:
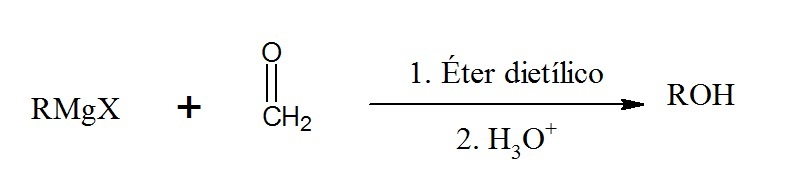
Los aldehídos al reaccionar con el reactivo de Grignard originan un alcohol secundario. La ecuación es similar como la de arriba, con la diferencia de que la fórmula del alcohol resultante es R2CHOH.
El reactivo de Grignard al reaccionar con una cetona origina un alcohol terciario:
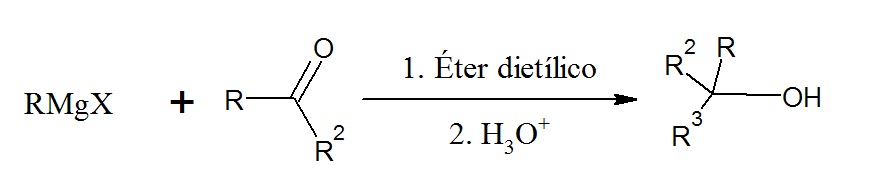
Nótese cómo este reactivo se utiliza para obtener alcoholes con mayor número de carbonos.
En esta reacción de síntesis se usa con más frecuencia el éster de metilo y el éster de etilo. Se requieren dos moles del reactivo de Grignard por mol de éster. El primer mol del reactivo de Grignard reacciona con el éster, formando una cetona y el halogenuro de metoximagnesio (CH2OMgX):
RMgX + R’-C(O)-OCH3 → R’-C(O)-R + CH2OMgX
Mientras, el segundo mol de reactivo de Grignard reacciona con la cetona para originar un alcohol terciario. Esta reacción ya se representó en la imagen anterior.
En esta reacción se forma un alcohol primario:
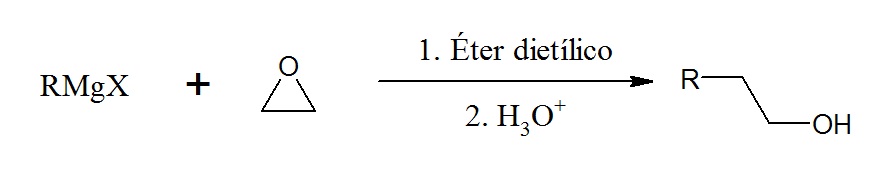
Cuando el reactivo de Grignard reacciona con el dióxido de carbono se producen ácidos carboxílicos.
Algunas de las aplicaciones aquí mencionadas se mostraron en la primera imagen.
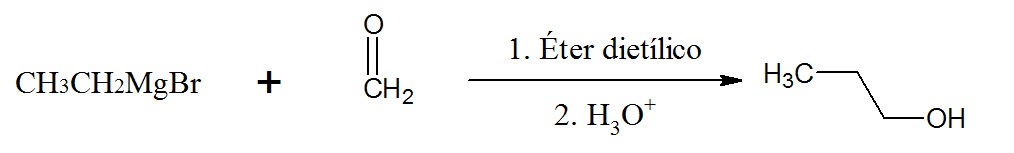
Nótese que el segmento etílico se une al grupo CH2 del formaldehido para formar el 1-propanol, un alcohol primario.
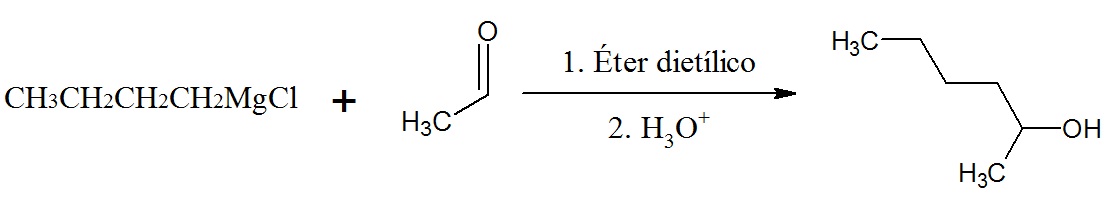
En esta reacción se produce un alcohol secundario: 2-hexanol.
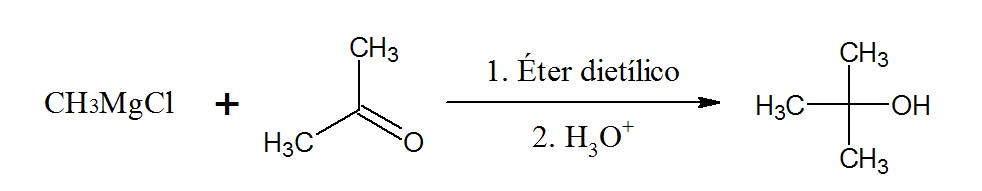
En este ejemplo la propanona, por ser una cetona, se transforma en el alcohol terciario 3-butanol al reaccionar con el cloruro de metilmagnesio.
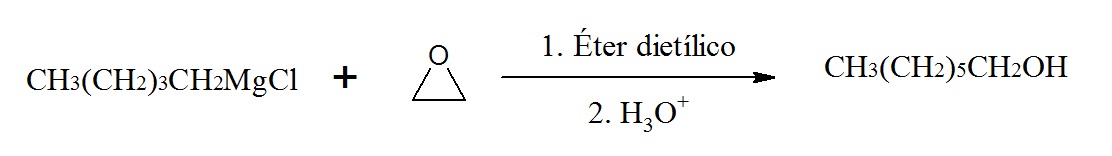
En este ejemplo el óxido de etileno reacciona con el cloruro de pentilmagnesio para formar el alcohol 1-heptanol.
El bromuro de arilmagnesio y el éter dietílico reaccionan con un haluro de vinilo, RCH=CHX o R2C=CHX, para sintetizar el estireno. Este compuesto se utiliza para fabricar cauchos, plásticos, materiales aislantes, cañerías, envases de alimentos, partes de automóviles, etc.
El reactivo de Grinard es usado en la producción de Tamoxifen, fármaco usado en el tratamiento del cáncer de seno.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Grignard reagent. Recuperado de: en.wikipedia.org
- Clark Jim. (2015). An Introduction to Grignard Reagents. Recuperado de: chemguide.co.uk
- Sudha Korwar. (07 de septiembre de 2017). The Application of a Continuous Grignard Reaction in the Preparation of Fluconazole. Chemistry Europe. doi.org/10.1002/ejoc.201701002
- Seyferth Dietmar. (16 de marzo de 2009). The Grignard Reagents. Organometallics , 28, 6, 1598–1605. doi.org/10.1021/om900088z. American Chemical Society.
