Óxidos básicos: concepto, propiedades, formación, ejemplos

¿Qué son los óxidos básicos?
Los óxidos básicos son compuestos inorgánicos que se forman por la unión entre oxígeno y un metal. Se llaman óxidos básicos porque producen soluciones alcalinas o básicas al disolverse en agua. También porque reaccionan con ácidos para formar una sal y agua por medio de una reacción de neutralización ácido-base.
Los óxidos básicos son muy comunes. De hecho, la mayoría de los metales en la naturaleza se encuentran en los suelos en forma de óxidos, por lo que antiguamente se les solía denominar tierras.
Los óxidos básicos son de gran importancia para la industria. Muchos pigmentos de colores utilizados en la industria son óxidos. Otros óxidos se utilizan como base para pinturas, en especial los óxidos de titanio, plomo y cinc.
Propiedades de los óxidos básicos
Son compuestos binarios
Estos compuestos están formados solo por dos elementos: oxígeno y un metal. Por lo tanto, son compuestos binarios.
Su fórmula empírica es M2OX o MOX/2
La valencia del oxígeno en los óxidos siempre es -2, entonces las fórmulas empíricas de los óxidos se simplifican cuando la valencia del metal es un número par. Sin embargo, no sucede lo mismo cuando es impar.
Por ejemplo, la fórmula empírica del óxido de sodio es Na2O porque el sodio tiene valencia +1 (impar). En cambio, la fórmula empírica del óxido de calcio es CaO, ya que el calcio tiene valencia +2.
Son compuestos inorgánicos, casi siempre de carácter iónico
La mayoría de los óxidos básicos son compuestos iónicos cristalinos. Esto incluye los óxidos de todos los metales alcalinos, de todos los alcalinotérreos (a excepción del berilio) y de la primera serie de los metales de transición.
Poseen puntos de fusión y ebullición muy altos
El enlace iónico mantiene fuertemente unidos a todos los iones que forman a los óxidos básicos. Esto hace que sean difíciles de derretir y más difícil aún de vaporizar. Por esta razón, poseen puntos de fusión y ebullición muy altos.
Son sólidos a temperatura ambiente
Por el mismo hecho de poseer puntos de fusión altos, todos los óxidos básicos son sólidos a temperatura ambiente.
Son compuestos básicos
La razón por la que se denominan óxidos básicos es precisamente por sus propiedades ácido-base. Los óxidos con mayor carácter iónico producen soluciones básicas al disolverse en agua y también reaccionan con ácidos, neutralizándolos.
Sin embargo, cabe resaltar que no todos los óxidos de los metales son básicos. Algunos son neutros, otros ácidos y otros anfóteros.
La mayoría son poco solubles o insolubles en agua
Todos los óxidos básicos son insolubles en agua, a excepción de los óxidos de los metales alcalinos y el de bario. Sin embargo, sí son solubles en soluciones ácidas.
¿Cómo se forman los óxidos básicos?
Los óxidos básicos se pueden formar de manera espontánea cuando los metales son expuestos al oxígeno del aire. De hecho, las capas de corrosión que se forman en la superficie de los metales consisten en diferentes óxidos básicos.
El metal involucrado, en general es un metal alcalino, alcalinotérreo o un metal de transición.
Se pueden escribir tres reacciones generales para la formación de los óxidos, dependiendo de si la valencia del metal es par o impar:
Para metales con valencias impares:
Cuando el metal tiene valencia impar, la reacción general de formación del óxido es:

Por ejemplo, para la formación del óxido de sodio, donde el sodio tiene valencia +1, la reacción es:

Otro ejemplo es la formación del óxido férrico, en el que el hierro tiene estado de oxidación o valencia +3. En este caso, la reacción es:

Para metales con valencia +2:
Cuando el metal tiene valencia +2, la reacción general de formación del óxido es:

Por ejemplo, en el caso de la formación del óxido de calcio, donde el calcio tiene valencia +2, la reacción es:

Para metales con otras valencias pares:
Cuando el metal tiene valencias pares además de +2, la reacción general de formación del óxido es:
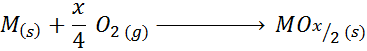
Un ejemplo de este caso es la reacción de formación del óxido de titanio (IV):

Nomenclatura de los óxidos básicos
Existen tres sistemas de nomenclatura para los óxidos básicos que son: la nomenclatura tradicional, la stock y la sistemática.
Para nombrar un óxido según los dos primeros sistemas de nomenclatura es necesario conocer la valencia del metal, mientras que para el último no.
Nomenclatura tradicional
Según la nomenclatura tradicional, los óxidos básicos se nombran comenzando con la palabra óxido seguida del nombre del catión. Este ultimo nombre, se construye colocando la raíz del nombre del metal y un sistema de prefijos y sufijos que indican la valencia del metal:
Óxido + Prefijo-Raíz-sufijo
Las reglas para asignar prefijos y sufijos se resumen en la siguiente tabla:
Número de valencias posibles | Valencia | Prefijo | Sufijo |
1 SOLA VALENCIA | |||
Única | --- | ___ico | |
2 VALENCIAS | |||
Mayor | --- | ___ico | |
Menor | --- | ___oso | |
3 VALENCIAS | |||
Mayor | --- | ___ico | |
Intermedia | --- | ___oso | |
Menor | Hipo___ | ___oso | |
4 VALENCIAS | |||
Mayor | Per___ | ___ico | |
Intermedia mayor | --- | ___ico | |
Intermedia menor | --- | ___ico | |
Menor | Hipo___ | ___ico |
Ejemplo:
El Fe2O3 es un óxido de hierro con valencia +3. El hierro solo tiene dos valencias que son +2 y +3, así que en este óxido el hierro tiene la mayor de dos valencias. Por esta razón, se agrega el sufijo ___ico a la raíz del nombre del metal hierro que es ferr-.
Por lo tanto, el nombre tradicional del Fe2O3 es: Óxido Férrico.
Nomenclatura stock
En este sistema, el nombre se construye comenzando con las palabras óxidode, seguido del nombre del metal. Finalmente, se coloca su valencia en números romanos entre paréntesis:
Óxido de + nombre del metal + (valencia)
En caso de que el metal solo tenga una valencia, ésta se omite.
Ejemplo:
En el Cr2O3 el cromo tiene valencia +3, así que el nombre Stock es Óxido de cromo (III).
Nomenclatura sistemática
Esta es la única de las tres nomenclaturas que no especifica la valencia del metal. Los nombres sitemáticos indican cuántos oxígenos y átomos del metal contiene el compuesto utilizando prefijos numéricos.
El nombre se construye con la palabra óxido precedida por el prefijo que indique el número de oxígenos, luego el artículo de seguido del nombre del metal con su respectivo prefijo.
Prefijo-óxido + de + prefijo-metal
Algunos prefijos son:
Número | Prefijo |
1 | Mono |
2 | Di |
3 | Tri |
4 | Tetra |
5 | Penta… |
Ejemplo:
En la nomenclatura sistemática, el Cr2O3 se llama trióxido de dicromo, ya que tiene tres oxígenos y dos cromos.
Ejemplos de óxidos básicos
- Óxido sódico – Na2O
- Óxido férrico – Fe2O3
- Monóxido de hierro – FeO
- Óxido crómico – Cr2O3
- Pentaóxido de divanadio – V2O5
- Óxido de potasio – K2O
- Óxido de bario – BaO
