Dibenzalacetona: propiedades, mecanismo de reacción, usos, riesgos
La dibenzalacetona (dba) es un compuesto orgánico cuya fórmula molecular es C17H14O. Se trata de un sólido amarillento que, dependiendo de su pureza, puede presentarse como cristales. Se utiliza en los protectores solares y en las síntesis organometálicas en las que se emplea al paladio como catalizador.
Si bien su síntesis es un proceso relativamente sencillo, bastante recurrente en los laboratorios de docencia para explicar la condensación aldólica, su mecanismo es un poco extenso, debiendo tenerse en cuenta varios factores. El benzaldehído que se utiliza, el cual condensará con la acetona, tiene que ser recién destilado para garantizar su baja oxidación en contacto con el aire.

Asimismo, se utiliza un medio básico etanol-agua para solubilizar los reactivos y, a la vez, promover la precipitación final de la dibenzalacetona, compuesto hidrofóbico e insoluble. Hasta el momento, no se conoce qué efectos negativos pueda ejercer la dibenzalacetona sobre el organismo o el medio ambiente, más que el de ser una sustancia irritante.
Índice del artículo
Sólido amarillento polvoriento o de apariencia cristalina.
234,29 g/mol
La dibenzalacetona se presenta como tres isómeros geométricos: trans-trans, trans-cis y cis-cis. El isómero trans-trans es de todos el más estable y, por tanto, el que más se produce durante la síntesis.
110-111 ºC. Este rango varía en función del grado de pureza del sólido sintetizado.
Insoluble.

En la imagen superior se muestra la molécula del isómero trans-trans dibenzalacetona, representada por un modelo de esferas y barras. En el centro de ella tenemos el grupo carbonilo, y a sus lados, unos dobles enlaces y dos anillos aromáticos de benceno.
La dibenzalacetona es en esencia apolar e hidrofóbica, pues toda su estructura se compone prácticamente de átomos de carbono e hidrógenos. El grupo carbonilo le confiere apenas un momento dipolar pequeño.
La estructura puede equipararse al de una hoja, ya que todos sus átomos de carbono tienen hibridación sp2; por lo tanto, descansan en un mismo plano.
Los fotones de la luz interaccionan con el sistema conjugado π de la dibenzalacetona; en especial, aquellos de la radiación UV, siendo absorbidos para excitar los electrones deslocalizados. Esta propiedad hace de la dibenzalacetona un excelente absorbente de la luz ultravioleta.
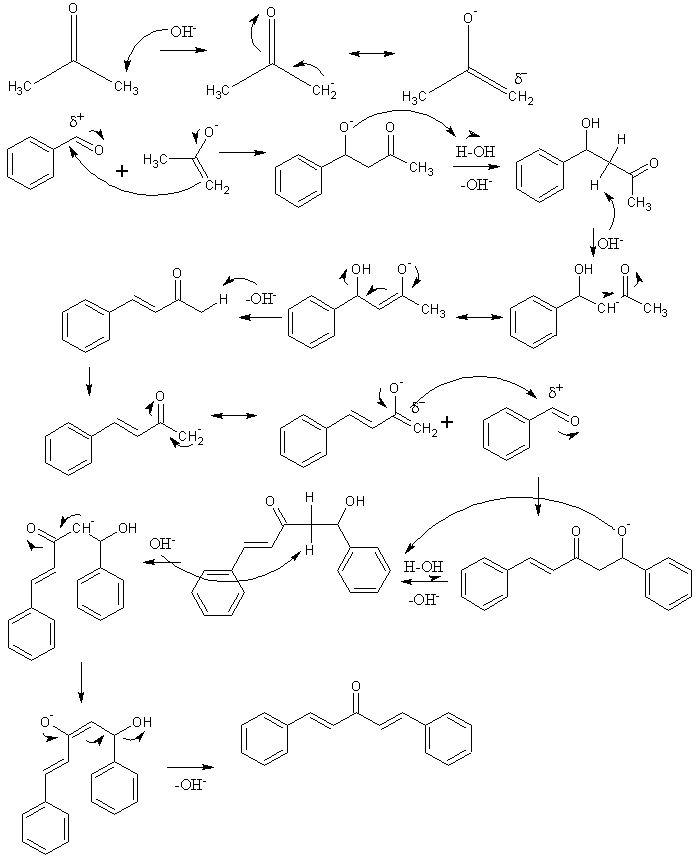
En la imagen superior tenemos representado el mecanismo de la condensación aldólica entre el benzaldehído y la acetona, para originar así la dibenzalacetona; específicamente, su isómero trans-trans.
La reacción comienza con la acetona en medio básico. El OH– desprotona un protón acídico de cualquiera de sus dos grupos metilos, -CH3, dando lugar a un enolato: CH3C(O)CH2–, el cual deslocaliza su carga negativa por resonancia (primera fila de la imagen).
Este enolato actúa luego como un agente nucleofílico: ataca al grupo carbonilo de una molécula de benzaldehído. Su incorporación al benzaldehído genera un alcóxido, que por ser muy básico desprotona una molécula de agua y se convierte en un aldol (segunda fila). El aldol o β-hidroxicetona se caracteriza por tener los grupos C=O y OH.
El medio básico deshidrata este aldol y se forma un doble enlace en su estructura, lo cual genera la bencilideneacetona (tercera fila). Seguidamente, el OH– también desprotona uno de sus hidrógenos acídicos, repitiéndose otro ataque nucleofílico a una segunda molécula de benzaldehído. Esta vez el ataque transcurre a menor rapidez (cuarta fila).
El producto formado desprotona otra molécula de agua y sufre nuevamente una deshidratación para eliminar el grupo OH y establecer un segundo doble enlace (quinta y sexta filas). Así y finalmente, se produce la dibenzalacetona.
Los reactivos para llevar a cabo la síntesis de la dibenzalacetona son los siguientes:
– Etanol al 95%.
– Benzaldehído recién destilado del aceite de almendras amargas.
– NaOH como catalizador básico en agua destilada.
Las cantidades a utilizar dependen de cuánta dibenzalacetona se pretenda sintetizar. Sin embargo, se busca que haya un exceso de benzaldehído, debido a que parte de él se oxida a ácido benzoico. Asimismo se garantiza que la reacción demore menos tiempo y que se produzca en menor proporción el indeseable bencilideneacetona.
El etanol actúa como solvente del benzaldehído, ya que de lo contrario no se disolvería en el medio básico de NaOH.
En un vaso de precipitado grande se mezcla el etanol con el benzaldehído. Luego se le añade durante agitación magnética constante el medio básico de NaOH. En este paso ocurre en menor grado la reacción de Cannizzaro; esto es, dos moléculas de benzaldehído se desproporcionan en una de alcohol bencílico y otra de ácido benzoico, fácilmente reconocible por su característico olor dulce.
Finalmente se adiciona la acetona y se espera media hora a que la disolución se torne turbia y de un color amarillo-anaranjado. La dibenzalacetona precipitará a causa del agua, por lo que se adiciona un volumen considerable de agua para promover su completa precipitación.
La dibenzalacetona se filtra al vacío y su sólido amarillento se lava varias veces con agua destilada.

Para purificar la dibenzalacetona se emplea etanol al 95% o acetato de etilo caliente, de modo que se obtenga cristales de mayor pureza por cada vez que se repita la recristalización. Así, el polvo amarillento inicial se transformará en unos pequeños cristales amarillos de dibenzalacetona.
La dibenzalacetona es un compuesto que no posee demasiados usos. Debido a su capacidad de absorber la luz ultravioleta, se utiliza en la formulación de los protectores solares, o de cualquier otro producto que busque aplacar la incidencia de los rayos UV, ya sea revestimientos o pinturas.
Por otro lado, la dibenzalacetona se utiliza en las síntesis organometálicas del paladio. Actúa como un ligante que se coordina a los átomos de paladio metálico, Pd0, para formar el complejo tris (dibencilideneacetona) dipaladio (0).
Este compuesto organometálico provee átomos Pd0 en distintas síntesis orgánicas, por lo que se comporta como un catalizador homogéneo, ya que se disuelve en muchos solventes orgánicos.
Asimismo, la dibenzalacetona como ligante es fácil de reemplazar por otros ligantes orgánicos, lo cual permite que se desarrollen rápidamente las síntesis organometálicas del paladio.
Respecto a los riesgos, no hay mucha información disponible que informe sobre los posibles impactos hacia la salud o al medio ambiente que pueda acarrear la dibenzalacetona. En su estado puro, es un sólido irritante por ingestión, respiración, o por contacto directo con los ojos o la piel.
No obstante, no es lo aparentemente lo suficiente irritante para que no pueda ser parte de las formulaciones de los protectores solares. Por otro lado, al ser tan insoluble en agua, su concentración en ella es despreciable, presentándose como un contaminante sólido. En este sentido, se desconoce qué tan nocivo resulta para la fauna marina o los suelos la turbidez que ocasiona.
Hasta que no se demuestre lo contrario, la dibenzalacetona se considerará un compuesto relativamente seguro, pues su escasa reactividad tampoco es motivo de riesgo ni de mayores precauciones.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Dibenzylideneacetone. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Dibenzylideneacetone. PubChem Database., CID=640180. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Organic Syntheses. (2020). Dibenzalacetone. Recuperado de: orgsyn.org
- Dibenzalacetone by Aldol Condensation. Recuperado de: web.mnstate.edu
