Fosfato de calcio (Ca3(PO4)2): estructura, propiedades y usos
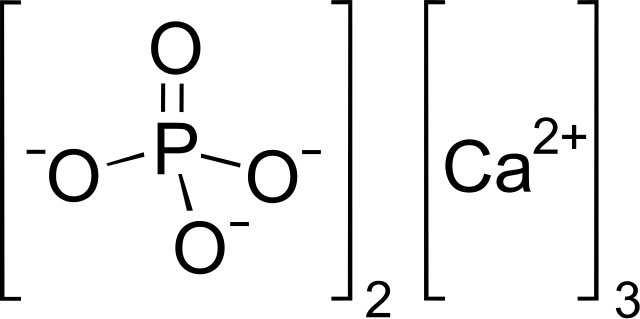
El fosfato de calcio es una sal inorgánica y terciaria cuya fórmula química es Ca3(PO4)2. La fórmula establece que la composición de esta sal es de 3:2 para el calcio y el fosfato, respectivamente. Esto puede verse directamente en la imagen inferior, donde se muestra el catión Ca2+ y el anión PO43-. Por cada tres Ca2+ hay dos PO43- interaccionando con ellos.
Por otro lado, el fosfato de calcio se refiere a una serie de sales que varían en función de la relación Ca/P, así como del grado de hidratación y el pH. De hecho, son muchos los tipos de fosfatos de calcio que existen y pueden sintetizarse. Sin embargo, siguiendo al pie de la letra la nomenclatura, el fosfato de calcio alude únicamente al tricálcico, el ya mencionado.
Todos los fosfatos de calcio, incluyendo al Ca3(PO4)2, son sólidos de color blanco con ligeras tonalidades grisáceas. Pueden ser granulares, finos, cristalinos, y tener tamaños de partículas que rondan los micrómetros; e inclusive, se han preparado nanopartículas de estos fosfatos, con las cuales se diseñan materiales biocompatibles para los huesos.
Esta biocompatibilidad se debe a que estas sales se encuentran en los dientes y en resumidas cuentas en los tejidos óseos de los mamíferos. Por ejemplo, la hidroxiapatita es un fosfato de calcio cristalino, los cuales a su vez interaccionan con una fase amorfa de la misma sal.
Esto significa que existen fosfatos de calcios amorfos y cristalinos. Por esa razón no es de extrañar la diversidad y múltiples opciones al momento de sintetizar materiales con base de fosfatos de calcio; materiales en cuyas propiedades cada día se muestran más interesados investigadores a nivel mundial para focalizarse en la restauración de los huesos.
Índice del artículo

En la imagen superior se muestra la estructura del fosfato de calico tribásico en el extraño mineral whitlockita, el cual puede contener magnesio y hierro como impurezas.
Aunque a primera vista pueda parecer compleja, es necesario aclarar que el modelo asume interacciones covalentes entre los átomos de oxígeno de los fosfatos y los centros metálicos de calcio.
A modo de representación resulta válido, sin embargo, las interacciones son electrostáticas; es decir, los cationes Ca2+ sienten atracción por los aniones PO43- (Ca2+— O-PO33-). Con esto en mente, se entiende por qué en la imagen el calcio (esferas verdes) están rodeadas de los átomos de oxígeno cargados negativamente (esferas rojas).
Al haber tantos iones, no deja visible un arreglo o patrón simétrico. El Ca3(PO4)2 adopta a bajas temperaturas (T1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, por sus siglas en inglés).
A altas temperaturas, por otra parte, se transforma en el polimorfo α-Ca3(PO4)2 (α-TCP), cuya celda unitaria corresponde a un sistema cristalino monoclínico. A temperaturas aún más altas, puede además formarse el polimorfo α’-Ca3(PO4)2, el cual es de estructura cristalina hexagonal.
Se han mencionado estructuras cristalinas para el fosfato de calcio, lo cual es de esperarse de una sal. Sin embargo, este es capaz de exhibir estructuras desordenadas y asimétricas, vinculadas más a un tipo de “vidrio cálcico de fosfato” que al de unos cristales en el estricto sentido de su definición.
Cuando esto ocurre, se dice que el fosfato de calcio presenta una estructura amorfa (ACP, amorphous calcium phosphate). Varios autores señalan a este tipo de estructura como la responsable de las propiedades biológicas del Ca3(PO4)2 en los tejidos óseos, siendo posible su reparación y biomimetización.
Mediante la elucidación de su estructura por resonancia magnética nuclear (RMN), se ha encontrado la presencia de iones OH– y HPO42- en el ACP. Estos iones se forman producto de la hidrólisis de uno de los fosfatos:
PO43- + H2O => HPO42- + OH–
Como resultado, la verdadera estructura del ACP se torna más compleja, cuya composición de sus iones se representa con la fórmula: Ca9(PO4)6-x(HPO4)x(OH)x. La ‘x’ indica el grado de hidratación, ya que si x=1, entonces la fórmula quedaría como: Ca9(PO4)5(HPO4)(OH).
Las diferentes estructuras que pueda tener el ACP dependen de las relaciones molares Ca/P; es decir, de las cantidades relativas de calcio y fosfato, las cuales cambian toda su composición resultante.
Los fosfatos de calcio son de hecho una familia de compuestos inorgánicos, que a su vez pueden interactuar con una matriz orgánica.
Los otros fosfatos se obtienen “simplemente” cambiando los aniones que acompañan al calcio (PO43-, HPO42-, H2PO4–, OH–), al igual que el tipo de impurezas en el sólido. Así, hasta once fosfatos de calcio o más, cada uno con estructura y propiedades propias, se pueden originar natural o artificialmente.
A continuación se mencionarán algunos fosfatos y sus respectivas estructuras y fórmulas químicas:
-Hidrógeno fosfato de calcio dihidratado, CaHPO4∙2H2O: monoclínica.
-Dihidrógeno fosfato de calcio monohidratado, Ca(H2PO4)2∙H2O: triclínica.
-Fosfato diácido anhidro, Ca(H2PO4)2: triclínica.
-Hidrógeno fosfato octacálcico (OCP, por sus siglas en inglés), Ca8H2(PO4)6: triclínica. Es precursor en la síntesis de la hidroxiapatita.
-Hidroxiapatita, Ca5(PO4)3OH: hexagonal.
-Fosfato de calcio
-Fosfato tricálcico
-Difosfato tricálcico
310,74 g/mol.
Es un sólido blanco inodoro.
Insípido.
1670 ºK (1391 ºC).
-Prácticamente insoluble en agua.
-Insoluble en etanol.
-Soluble en ácido clorhídrico y en ácido nítrico diluidos.
3,14 g/cm3.
1,629
4126 kcal/mol.
2-8 ºC.
6-8 en una suspensión acuosa de 50 g/L de fosfato de calcio.
Existen numerosos métodos para poder producir o formar el fosfato de calcio. Uno de ellos consiste de una mezcla de dos sales, Ca(NO3)2∙4H2O, y (NH4)2HPO4, disueltas previamente en alcohol absoluto y agua, respectivamente. Una sal aporta el calcio, y la otra el fosfato.
A partir de esta mezcla precipita el ACP, el cual luego se somete a calentamiento en un horno a 800°C y por 2 horas. Como resultado de este procedimiento, se obtiene el β-Ca3(PO4)2. Controlando cuidadosamente las temperaturas, la agitación y los tiempos de contacto, puede darse la formación de nanocristales.
Para formar el polimorfo α-Ca3(PO4)2 es necesario calentar el fosfato por encima de los 1000°C. Este calentamiento se lleva en presencia de otros iones metálicos, los cuales estabilizan este polimorfo lo suficiente para que pueda utilizarse a temperatura ambiente; es decir, permanece en un estado meta estable.
El fosfato de calcio también puede formarse mezclando las disoluciones de hidróxido de calcio y ácido fosfórico, ocurriendo una neutralización ácido-base. Después de medio día de maduración en los licores madres, y de su debida filtración, lavado, secado y tamizado, se obtiene un polvo granular de fosfato amorfo, ACP.
Este ACP reacciones producto de las altas temperaturas, transformándose de acuerdo a las siguientes ecuaciones químicas:
2Ca9(HPO4)(PO4)5(OH) => 2Ca9(P2O7)0,5(PO4)5(OH) + H2O (a T=446,60°C)
2Ca9(P2O7)0,5(PO4)5(OH) => 3Ca3(PO4)2 + 0,5H2O (a T= 748,56°C)
De esta manera se obtiene el β-Ca3(PO4)2, su polimorfo más común y estable.
El Ca3(PO4)2 es el constituyente inorgánico principal de las cenizas de huesos. Es un componente de los trasplantes de reemplazo óseo, siendo esto explicado por su similitud química con los minerales presentes en el hueso.
Los biomateriales de fosfato de calcio son utilizados para corregir los defectos óseos y en el recubrimiento de las prótesis del metal titanio. El fosfato de calcio se deposita sobre ellas, aislándolas del ambiente y enlenteciendo el proceso de corrosión del titanio.
Los fosfatos de calcio, incluyendo el Ca3(PO4)2, se utilizan para la elaboración de materiales cerámicos. Estos materiales son biocompatibles, y se emplean actualmente para restaurar la pérdida ósea alveolar, resultante de la enfermedad periodontal, las infecciones endodónticas y otras afecciones.
Sin embargo, deben usarse solamente para acelerar la reparación ósea periapical, en áreas donde no exista una infección bacteriana crónica.
Se puede emplear el fosfato de calcio en la reparación de defectos óseos, cuando no es posible emplear un injerto óseo autógeno. Es posible emplearlo solo o en combinación con un polímero biodegradable y reabsorbible, como el ácido poliglicólico.
El cemento de fosfato de calcio (CPC) es otro biocerámico utilizado en la reparación del tejido óseo. Se elabora mezclando el polvo de diferentes tipos de fosfatos de calcio con agua, formándose una pasta. La pasta puede ser inyectada o ajustada al defecto óseo o cavidad.
Los cementos se moldean, se reabsorben gradualmente y son reemplazados por el hueso recién formado.
-El Ca3(PO4)2 es una sal básica, por lo que se emplea como antiácido para neutralizar el exceso de acidez estomacal y aumentar el pH. En las pastas dentales suministra una fuente de calcio y fosfato para facilitar el proceso de remineralización de los dientes y la hemostasia ósea.
-También se usa como suplemento nutricional, aunque la forma más económica de suplir el calcio es mediante la utilización de su carbonato y citrato.
-El fosfato de calcio puede utilizarse en el tratamiento de la tetania, la hipocalcemia latente y la terapia de mantenimiento. Además, es útil en la suplementación de calcio durante el embarazo y la lactancia.
-Se utiliza en el tratamiento de una contaminación con los isotopos radiactivos radio (Ra-226) y estroncio (Sr-90). El fosfato de calcio bloquea la absorción de los isotopos radiactivos en el tubo digestivo, limitando así el daño causado por ellos.
-El fosfato de calcio se usa como pienso para las aves. Además, se utiliza en las pastas dentales en el control del sarro.
-Se emplea como agente antiaglomerante, por ejemplo para evitar que la sal de mesa se compacte.
-Funciona como un agente blanqueador de la harina. Mientras, en la manteca de cochino previene una coloración indeseada y mejora la condición de la fritura.
- Tung M.S. (1998) Calcium Phosphates: Structure, Composition, Solubility, and Stability. In: Amjad Z. (eds) Calcium Phosphates in Biological and Industrial Systems. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu, and Honglian Dai. (2018). “Synthesis, Characterization of Nano-β-Tricalcium Phosphate and the Inhibition on Hepatocellular Carcinoma Cells,” Journal of Nanomaterials, vol. 2018, Article ID 7083416, 7 pages, 2018.
- Combes, Christ and Rey, Christian. (2010). Amorphous calcium phosphates: synthesis, properties and uses in biomaterials. Acta Biomaterialia, vol. 6 (n° 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalcium phosphate. Recuperado de: en.wikipedia.org
- Abida y col. (2017). Tricalcium phosphate powder: Preparation, characterization and compaction abilities. Mediterranean Journal of Chemistry 2017, 6(3), 71-76.
- PubChem. (2019). Calcium phosphate. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Calcium phosphate. Science Direct. Recuperado de: sciencedirect.com
