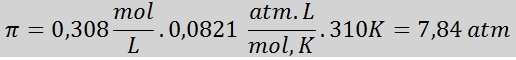Propiedades coligativas: concepto, explicación, formulas, ejemplos
¿Qué son las propiedades coligativas?
Las propiedades coligativas, también llamadas propiedades colectivas de las soluciones, son un grupo de cuatro propiedades que dependen únicamente de la cantidad de partículas presentes en la solución, pero no de la naturaleza de dichas partículas.
En otras palabras, estas propiedades surgen de la presencia de partículas distintas al solvente, es decir, partículas del soluto, pero no dependen de quién sea el soluto. Cualquier tipo de partícula puede dar origen a propiedades coligativas, no importa si se trata de átomos, iones o moléculas. Lo único que importa es su concentración.
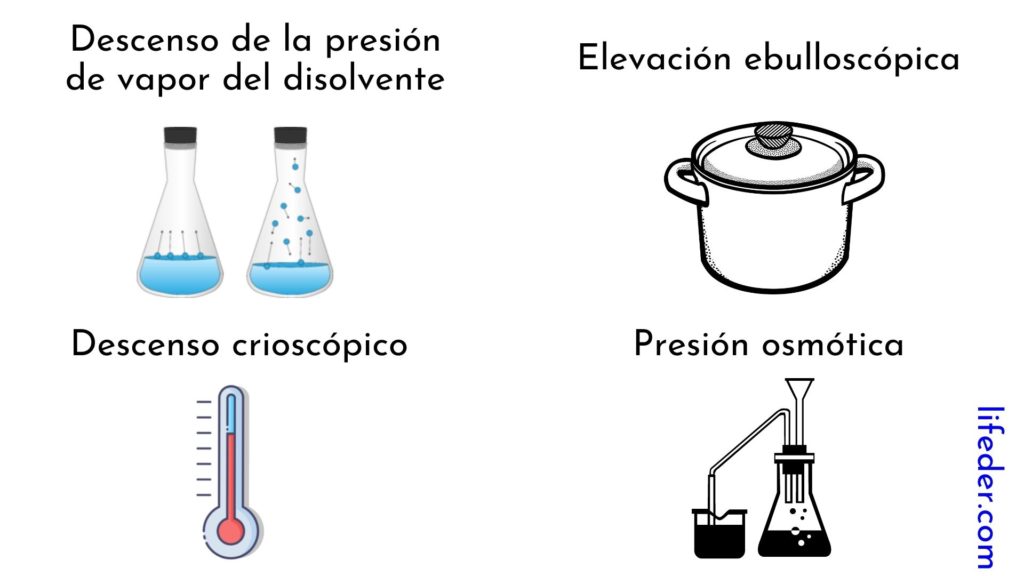
Las propiedades coligativas son cuatro:
- Descenso de la presión de vapor del disolvente
- Elevación ebulloscópica
- Descenso crioscópico
- Presión osmótica
Todas se caracterizan por ser proporcionales a la concentración del soluto en el caso de soluciones relativamente diluidas (concentración 0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Veamos cada una de estas cuatro propiedades en detalle:
1. Descenso de la presión de vapor del disolvente
Cuando se prepara una solución de un soluto no volátil, la presión de vapor de la solución resultante siempre es menor que la presión de vapor del solvente puro. En otras palabras, disolver un soluto no volátil en un solvente, causa un descenso en la presión de vapor de dicho disolvente, en comparación con el solvente puro.
Fórmula del descenso de la presión de vapor
Como todas las propiedades coligativas, el descenso de la presión de vapor (DP) es proporcional a la concentración del soluto. Combinando la ley de Raoult con las ecuaciones de fracción molar, se puede demostrar que DP viene dado por:
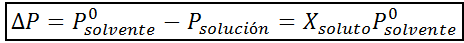
donde P°solvente representa la presión de vapor del solvente puro a una temperatura determinada, Psolución corresponde a la presión de vapor de la solución y Xsoluto representa la concentración del soluto expresada como fracción molar.
¿Por qué disminuye la presión de vapor con el soluto?
La fuerza que impulsa a la mayoría de los procesos naturales, tales como la evaporación de un solvente, es el aumento de entropía o nivel de desorden. Cuando un líquido se evapora, pasa de un estado muy ordenado (en el líquido) a uno muy desordenado (en el gas), ya que en la fase gaseosa hay mucha más libertad de movimiento.
Sin embargo, en una solución, la presencia del soluto añade desorden a la fase líquida mientras que no afecta la fase gaseosa (ya que el soluto no se evapora).
Por esta razón, la diferencia en el nivel de desorden entre la solución y la fase gaseosa es menor que entre el solvente puro y la fase gaseosa, por lo que el solvente tiene menos tendencia a evaporarse en el segundo caso.
Ejemplo
Problema: sabiendo que la presión de vapor del agua a cierta temperatura es de 30,55 mmHg, determinar la presión de vapor de una solución preparada disolviendo 7,20 gramos de glucosa (masa molar o MM= 180g/mol) en 360 g de agua (MM=18,0 g/mol) a la misma temperatura.
Solución: en este caso se debe calcular primero la fracción molar del soluto. Ya tenemos todos los datos necesarios para ello:
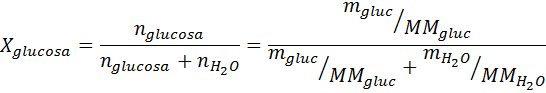
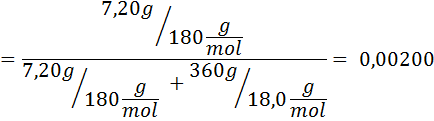
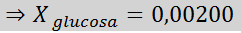
Luego se aplica la ecuación del descenso de la presión de vapor.
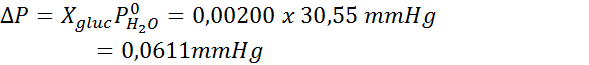
Ahora determinamos la nueva presión de vapor del solvente:
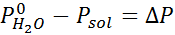
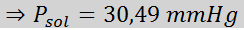
2. Elevación ebulloscópica o aumento del punto de ebullición
La elevación ebulloscópica se refiere al aumento en el punto de ebullición de una solución comparado con el punto de ebullición del solvente puro. Para entender por qué esto sucede, recordemos que el punto de ebullición se define como la temperatura a la que la presión de vapor de un líquido se hace igual a la presión atmosférica.
Como las soluciones tienen una presión de vapor menor que el solvente puro (como acabamos de ver en la sección anterior), es necesario calentarla más para poder alcanzar la presión atmosférica y así alcanzar su punto de ebullición. Por esta razón, el punto de ebullición de las soluciones (con solutos no volátiles) siempre es mayor que el del solvente puro.
Fórmula de la elevación ebulloscópica
El aumento del punto de ebullición (DTb) es proporcional a la concentración del soluto expresado en molalidad, como indica la siguiente ecuación:
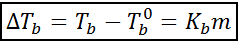
Donde Tb es el punto de ebullición de la solución, Tb° es el punto de ebullición del solvente puro, Kb es la constante ebulloscópica del solvente y m es la molalidad del soluto.
Ejemplo
Problema: sabiendo que la constante ebulloscópica del agua es 0,52 °C.kg/mol, determine el punto de ebullición de la solución de glucosa preparada en el ejemplo anterior.
Solución: para determinar la elevación ebulloscópica solo nos hace falta la molalidad.
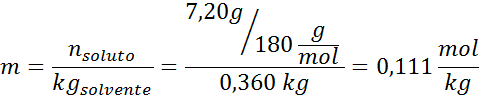
Ahora aplicamos la fórmula de DTb:
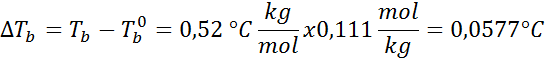
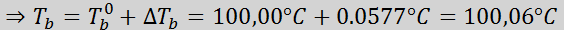
3. Descenso crioscópico
El descenso crioscópico es la disminución del punto de congelación de una solución comparado con el punto de congelación del solvente puro. La razón por la que esto sucede es similar al aumento ebulloscópico y tiene su origen en la disminución de la presión de vapor.
Esta propiedad se utiliza mucho en los países de clima frío dónde nieva en invierno. En dichos países, es muy común ver camiones esparciendo sales como NaCl o CaCl2 en las carreteras o en las bancas públicas, tras lo cual la nieve se derrite. La razón por la que se derrite es que la sal disminuye el punto de congelación del agua.
Fórmula del descenso crioscópico
La ecuación del descenso crioscópico es muy similar a la del aumento ebulloscópico. También es proporcional a la concentración molal y depende, en este caso, de una constante crioscópica del solvente.
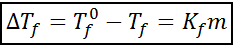
donde Tf es el punto de congelación de la solución, Tf° es el punto de congelación del solvente puro, Kf es la constante crioscópica del solvente y m es la molalidad del soluto.
Ejemplo
Problema: sabiendo que la constante crioscópica del agua es 1,86 °C.kg/mol, determine el punto de congelación de la solución de glucosa preparada en el ejemplo anterior.
Solución: ya se determinó la molalidad de la solución, así que podemos pasar directamente a determinar DTf utilizando la fórmula anterior:
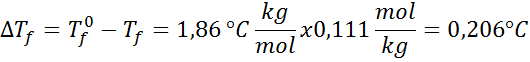
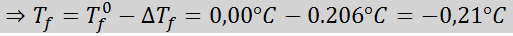
4. Presión osmótica
La ósmosis es un proceso de gran importancia a nivel químico y biológico. Esta consiste en el flujo de moléculas de solvente (por ejemplo, agua) desde una solución diluida hacia otra solución más concentrada cuando estas están separadas por medio de una membrana semipermeable (que solo deja pasar al solvente, pero no al soluto).
Esta tendencia a “absorber” solvente a través de una membrana semipermeable es una propiedad que depende únicamente de la concentración total de partículas de soluto presentes en la solución, sin importar de qué soluto se trate. Por esta razón, esta tendencia es una propiedad coligativa, y se mide a través de la presión osmótica.
La presión osmótica (π) es la presión que se debe aplicar sobre una solución para detener la ósmosis. Mientras mayor es la presión osmótica, más tendencia tiene la solución a absorber solvente (o, más precisamente, más tendencia tiene el solvente a difundir hacia dicha solución).
¿Por qué ocurre la ósmosis?
La explicación detrás del proceso de ósmosis es muy sencilla. Todas las sustancias tienden a difundir desde donde están más concentradas hacia donde están más diluidas. A esto se le dice seguir su gradiente de concentración.
Cuando una solución está más concentrada en soluto, al mismo tiempo está más diluida en solvente y viceversa. Por esta razón, el solvente tiene una tendencia natural de ir desde la solución más diluida (donde el solvente está más concentrado) hacia la solución más concentrada (donde está más diluido).
Fórmula de la presión osmótica
La presión osmótica se puede calcular con una fórmula muy similar a la ecuación de los gases ideales:
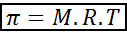
En esta ecuación, π es la presión osmótica, M es la concentración molar del soluto, R es la constante universal de los gases ideales (0,0821 atm.L/mol.K) y T es la temperatura absoluta en K.
Presión osmótica y tonicidad
La presión osmótica es muy importante para el funcionamiento del cuerpo humano. De hecho, las soluciones salinas que se inyectan por vía intravenosa se clasifican según si su presión osmótica es mayor, igual o menor que la del plasma sanguíneo a lo que se le denomina tonicidad.
- Una solución menos concentrada que el plasma tiene una menor presión osmótica y se le dice solución hipotónica.
- Si tiene la misma concentración total de solutos se le dice solución isotónica.
- Si tiene una presión osmótica (o concentración) mayor, se le dice solución hipertónica.
Ejemplo
Problema: calcule la presión osmótica a 310 K de una solución salina al 0,9% (m/V), la cual es isotónica con el plasma sanguíneo.
Solución: ya tenemos la temperatura, así que lo único que falta es determinar la concentración molar de las partículas de sal (NaCl) que hay en la solución. Para ello se debe tomar en cuenta el hecho de que el cloruro de sodio, al disolverse en agua, se separa en dos iones, por lo que la concentración total de partículas será el doble de la concentración total de la sal.
Cada 100 mL de solución contienen 0,9 g de NaCl, así que:
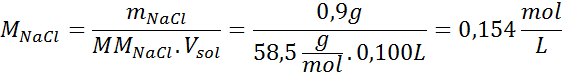
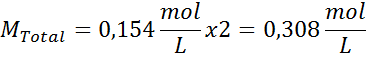
Esta es la concentración total de partículas de soluto que hay en la solución, así que ahora podemos calcular la presión osmótica: